构象
构造、构型与构象
在有机化学中有三个接近的名词:构造、构型与构象。这三个词比较容易混淆,但各自有着完全不同的含义。

构造、构型与构象
构造:分子中原子的连接情况,完全不涉及立体情况。比如HCl分子,两个原子只要是连接在一起,不管一个天上一个地上,一个北京一个南京,都算是一个构造。
构型:与立体结构有关,分子中特定原子排布的相对位置。注意,这是个相对的概念。典型的像考察两个原子在一个参考平面的同侧或是异侧。 若都在同侧,不论两个原子间距离如何,都算作是一个构型。
构象:也与立体结构有关,由于分子中σ键旋转引起的不同的立体样式。这个概念有点儿涉及原子的绝对坐标了,σ键旋转过一个角度, 各个原子三维坐标发生了变化,我们都算作是不同的构象。
一般来说,一个构造可能存在一个或者数个不同的构型,而一个构型又能产生多个(往往是无穷多个)构象。如2-丁醇,这么一个简单构造的分子实际存在 (R)-2-丁醇与(S)-2-丁醇两种不同的构型(R/S这样的构型标识在立体化学一章中会详述),而任一种构型由于σ键的旋转都又能产生无数的构象。
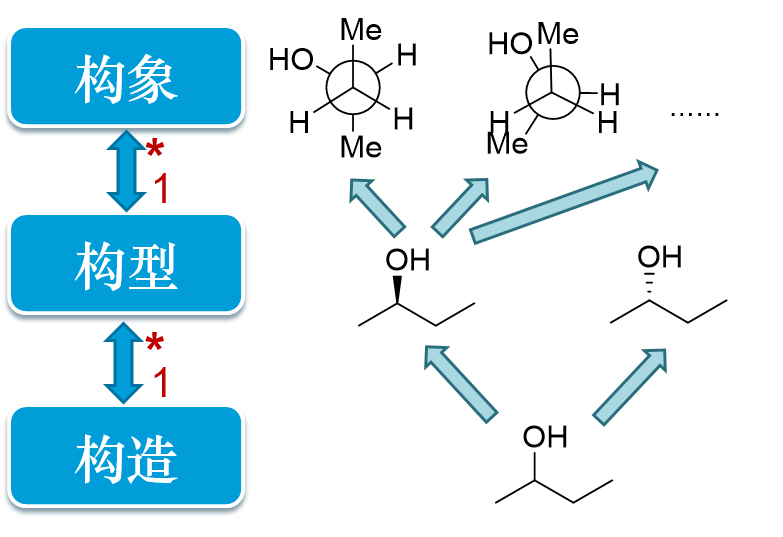
2-丁醇的构造、构型与构象
分子的构造特别简单,大家一看平面式就能明白;而关于构型,在后面立体化学基础一章中会再进行讨论;烷烃这章中,特别讨论了构象问题。 三个典型烷烃分子的构象相对最为重要:开链烷烃里的乙烷、丁烷以及环烷烃中的环己烷。
开链烷烃的构象
乙烷
乙烷的极限构象
乙烷仅分子中C-C键旋转才可能引起构象变化,相对比较简单。大家需要注意重叠式、交叉式这两种典型的极限构象。 前者两个碳原子上连接的氢原子相对距离最近,斥力最大,能量最高;而后者反之,距离最远能量最低。 水往低处流,根据玻尔兹曼分布,大量分子存在的情况下,同一时刻处于较低能量的交叉式分子的数目一定大于重叠式,也大于其它任何 构象,因而能量最低的交叉式构象被称作优势构象。
关于乙烷的分子构象变化,大家可以参见 在线的可交互模型 。 自己旋转一下C-C键,从各个角度观察一下,尤其注意两个碳上氢原子之间距离。必要时可以从球棍模型切换成比例模型,体会氢原子之间的斥力。
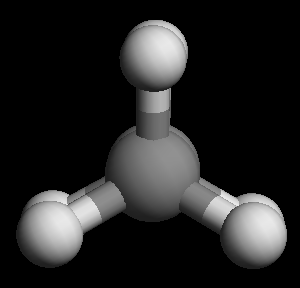
乙烷重叠式构象(球棍模型从C-C键方向观察)
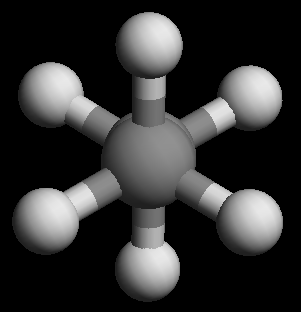
乙烷交叉式构象(球棍模型从C-C键方向观察)

乙烷重叠式构象(比例模型从C-C键上方观察)
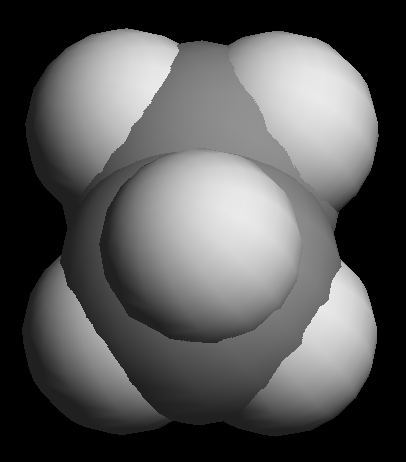
乙烷交叉式构象(比例模型从C-C键上方观察)
构象的纸面表达
此外,表达分子构象经常采用锯架式与纽曼投影式,外加之前的楔线式,目前我们已经至少学习了三种在纸面上 表达分子立体形态的方式。这三种形式说白了,其实就是分子不同角度在纸面上形成的投影,如下图所示:
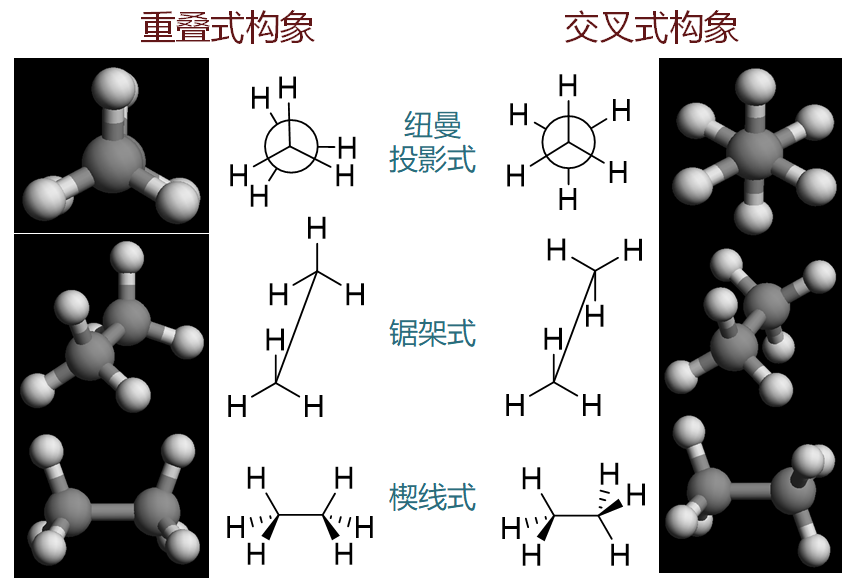
乙烷两种极限构象的平面画法
丁烷
为简化计,基础有机化学中我们只考虑2,3-位碳原子间C-C键旋转引起的构象变化。其实与乙烷非常类似,只不过把两个碳上各一个氢替换成了体积更大的甲基。 由于甲基的存在,丁烷的重叠式、交叉式不只一种,能量也不尽相同。还是那个基本原则,构象能量高低看相邻碳原子上连接的各原子/基团之间的距离,尤其是 两个较大的甲基之间的距离。大家也可以结合 丁烷构象示意模型 来进行理解。
环烷烃的构象
环烷烃的构象较开链烷烃复杂得多。受环结构的限制,构象变化时通常需要同时旋转多根σ键。由于过于复杂,因而基础有机中具体怎么一个旋转法 一般不作要求,大家只需要记得一些结论就好,尤其是最常见的环烷烃——环己烷的构象情况。
环己烷
椅式与船式构象
椅式与船式是环己烷的两种典型构象,这两种构象C-C、C-H键之间都能满足109.5度的正常sp3键角。 但我们也知道椅式远比船式稳定,其原因……课本的纽曼投影式示意图大家可能看不清楚,也不太容易想象。更简单的理解方式是直接 操作 环己烷椅式与船式交互模型 。 转个角度之后大家可以得到如下的结果:
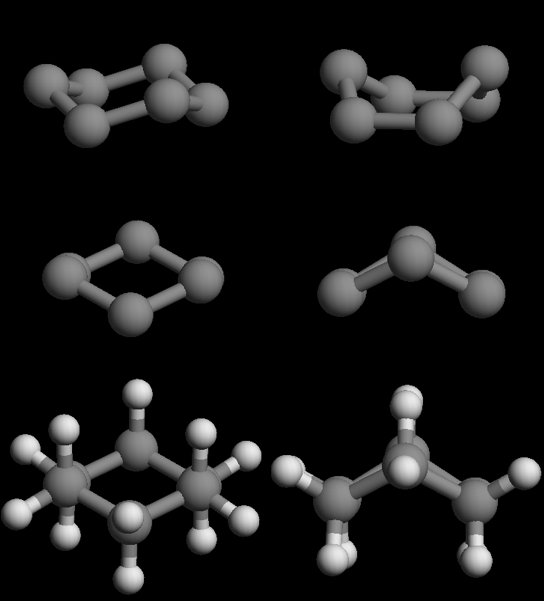
椅式与船式构象的比较。自上而下:侧面视角、沿C2-C3键方向视角、显氢
尤其是显示氢原子之后,大家一看就能明白,船式相邻碳原子相当于是重叠式,而椅式相邻碳原子相当于是交叉式。如此一来自然椅式 能量更低。
椅式也是环己烷所有构象中能量最低的一种,通常情况下在分子中占了绝对多数。一般提及环己烷的构象,我们也只把目光放在椅式上。
椅式的立体特征
椅式构象的核心是六个碳原子。为讨论方便,我们不妨逐个编号如下图。平面上表达椅式构象经常画成右侧的形状,默认靠下的2,3-位碳距我们较近 而5,6-位碳距我们较远在纸面后方。
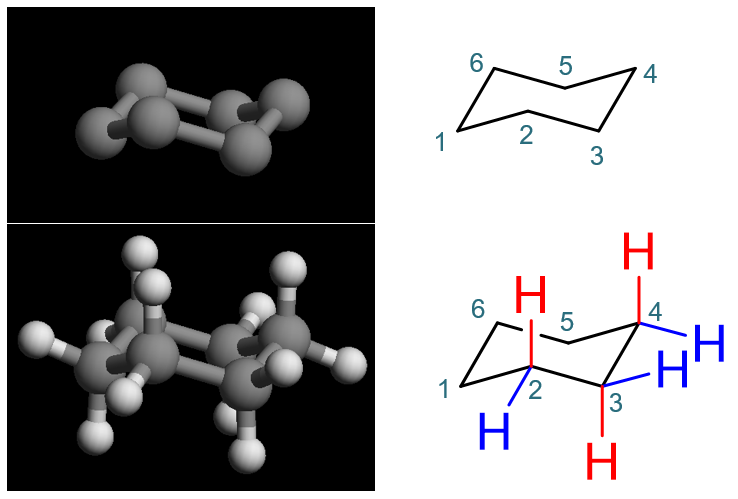
椅式的立体特征
1-6位碳我们可以人为地分成两组,1/3/5与2/4/6,两组各三个碳原子,各自三点决定一个平面,而明显这两个平面相互平行,某种意义上说, 可以将其称为环己烷的环平面。目前1/3/5处于下平面而2/4/6处于上平面。同时各根C-C键之间也有平行关系,如C1-C2平行于C4-C5,C1-C6平行于C3-C4等。
除去C-C键外,每个碳原子上还各自有两根C-H键。观察立体模型,我们不难发现这两根环外的键立体特征也非常明显。总有一根垂直于刚才的环平面, 称为竖直键或a键(注意,和直接相连的C-C键并不垂直,而是垂直于1/3/5、2/4/6的环平面),图中用红色标出。 此外处于下平面的C1、C3、C5这三个原子,它们的a键都垂直冲下;反之C2、C4、C6的a键都垂直冲上。这一点需要牢记,千万别弄反了。
另一根C-H键和环平面有个较小的角度,仿佛“趴”在环平面上,我们称其为平伏键或e键,图中用蓝色标出。 仔细观察我们会发现,e键实际会与环上某根C-C键平行,如3-位碳原子的e键,与C4-C5及C1-C2平行。
这些垂直或平行关系,都可以通过sp3杂化的109.5度键角从立体几何的角度加以证明。
e键伸出环外,e键上连接的原子或基团距其它原子之间距离一般也较大,斥力不大。而a键都垂直于环平面,互相之间都是平行关系,端头的原子/基团 距离较小,可能会存在明显的斥力,这对环己烷衍生物分子的构象能量有着决定性的影响。我们课本中甲基环己烷的例子,包括后面立体化学一章中 多取代环己烷的例子,其实都是在考察a键基团互相之间的斥力大小。
椅式的翻环
特别值得注意的是,环己烷的椅式在通常情况下会发生所谓的“翻环”,通过一系列C-C键的旋转,得到看起来挺对称的另一个不同的椅式。 翻环具体过程比较复杂,中间会经历一系列其它构象。简单里说,如下图所示,大致是原本处于下平面的C1这个角向上翘,而原本处于上平面的 C4角向下压,最终得到最右侧的一个新椅式。
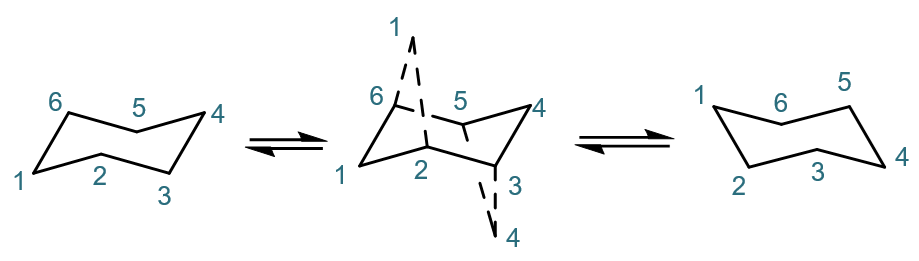
椅式翻环示意
得到的新椅式构象和原先的椅式相比,各原子的左右、前后关系不变,如C1依然在最左方,C4依然最右方;C2、C3依然在纸面前,C5、C6依然在纸面后。 但上下关系发生了倒转,原本处于下平面的C1、C3、C5现在反而处于上平面;反之C2、C4、C6处于了下平面。大家也一定留神这组关系。
除此之外,更重要的,翻环之后a、e键也将发生倒转。旧的a键翻环后会处于平伏位,反之旧e键翻环后将垂直环平面,如下图所示。具体怎么倒转的, 过程同样复杂,大家也不用多管,记得这么个结论就成。
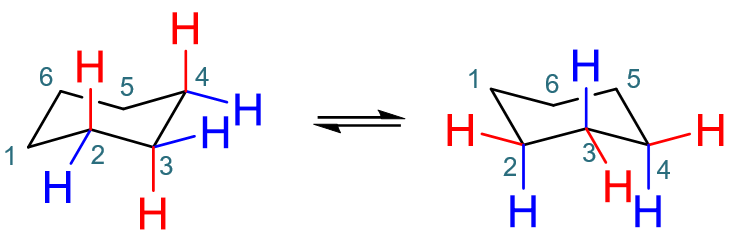
椅式翻环后a、e键互相转换
如果就是单纯的环己烷,翻环前后不管a、e键,反之都是十二个氢,左右两种构象其实没啥差别,能量也完全相同。但如果环旁侧连接了取代基,情况将会 发生变化。如甲基环己烷的翻环(注意这里的数字并非系统命名里的编号,仅作位置标注之用):
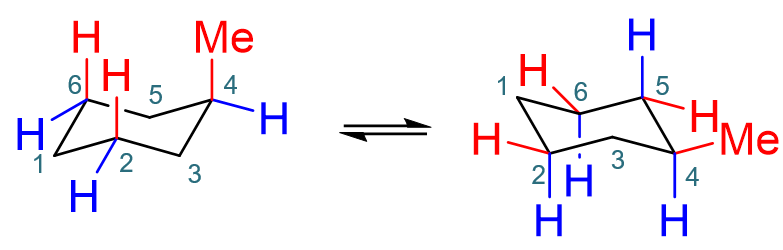
甲基环己烷的椅式翻环
若旧椅式甲基在a键,翻环后自然将转到e键去。而之前我们就提到,a键基团之间存在明显的斥力。左侧构象是甲基及平行的C2、C6上两个a键氢原子间有明显斥力; 右侧甲基处于e键伸出环外,仅C2、C4、C6上a键的氢原子间有明显斥力。甲基的体积又较氢原子大得多,自然空间位阻更大,斥力更强。于是右侧椅式构象能量 将明显低于左侧,是甲基烷基烷的优势构象。
这是单取代环己烷的情况,优势构象里大基团一般一定处于e键上。如果是多取代环己烷,情况将更加复杂,还同分子的构型有关。这将在立体化学一章中讨论。
备注
分子是动态的,时时发生变化的,构象之间互相转化的能垒一般不高,室温下就可以翻越。因此发生反应时,分子并不见得一定处于优势构象。
椅式在纸面上的画法
环己烷的椅式构象非常常用,我们在日常学习中经常也有在纸面示意性地画出椅式的要求。挺多同学没掌握窍门,画出的椅式比较难看。 这里顺便提一下通常情况下椅式的画法。
我们之前考察立体模型时已经注意到了椅式的一系列平行关系,实际绘画时,完全可以借助这些平行特征,如下图所示。 通常我们可以先画出C1-C6-C5-C4这三根键,三根键差不多长度,一个Z字形,注意C4-C5这根键的斜率要比C1-C6小一些。 这三根确定后,底下就可以充分利用平行关系了。如从C4开始作一根C1-C6的等长平行线段,得到C4-C3;再从C3起始,作C5-C6平行线段 得到C2,最后连起C1-C2,一个挺漂亮的椅式就出现了。
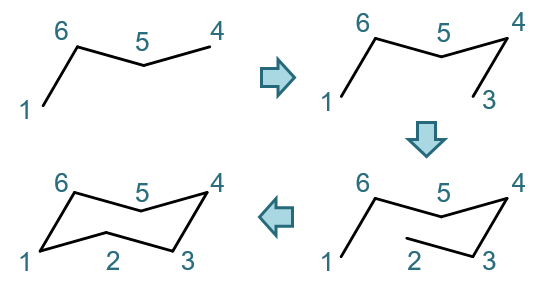
环己烷椅式的基本画法
至于椅式上的a、e键,作图时依然还是利用几何关系,如下图所示。如C3上的e键,平行于C4-C5;而a键垂直于C1-C3-C5平面且向下,做个向下的垂线就成。 类似的,C6的e键平行于C1-C2,a键则垂直向上。
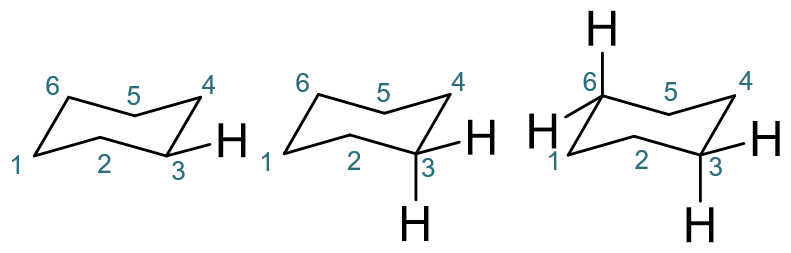
环己烷椅式a、e键的基本画法