无手性中心的手性分子
在基础有机化学的学习中,我们遇到的绝大多数手性分子都是具有手性中心的。但手性中心与手性存在与否并没有必然的联系, 很多手性分子中压根儿就没有手性中心的存在。在立体化学一章中,我们也粗略地接触了部分这样的分子。
无手性中心的手性分子的常见类别
我们在基础有机化学中接触的无手性中心的手性分子基本分三大类:螺旋型的、有手性面的、有手性轴的。其中又以具有手性轴的分子相对更为重要。
螺旋型化合物
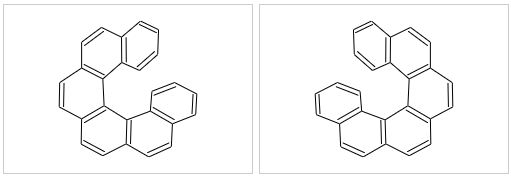
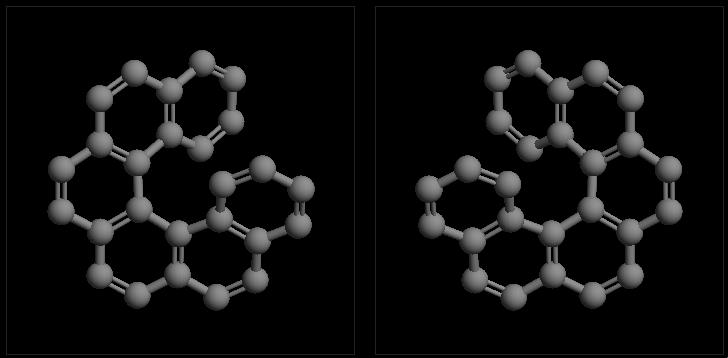
典型的如下图中的分子,一系列苯环拼合在一起。正常情况下,苯环上所有原子应当共面。但下图分子若各环原子共面的话,端头两对碳原子之间距离将极近, 空间斥力极大。因而整个分子的环系实际会扭转开一个角度,像螺旋楼梯似的。而螺旋存在左旋、右旋两种取向,互为镜像但不能重叠,是一对对映异构体。
具有手性面的化合物
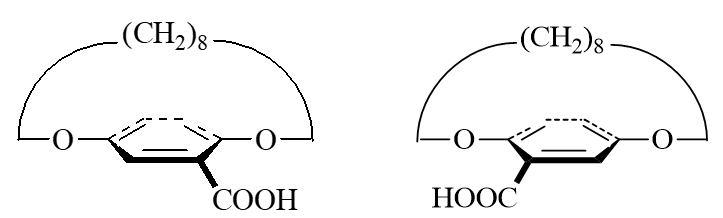
典型如下图中的分子,整体形状仿佛是个提篮,下方苯环是篮底,上方长链是篮柄。若篮底苯环上没有侧链取代基,则整个分子存在对称面,无手性。 但若篮底苯环上分布着不对称的取代基,则分子与其镜像不能重叠,手性随之出现。
具有手性轴的化合物
这类分子在基础有机的学习中相对较常见,也比较重要。典型的如累积二烯、联苯与螺环衍生物。
累积二烯衍生物
所谓累积二烯,指的是两根双键紧邻,连接在同一碳原子上的二烯烃。它的结构如下图所示,中间碳原子已经四价,不会再连接其它基团, 而双键端头两个碳原子,各自还有两根σ键。由于杂化形态的原因(具体在后面二烯烃一节会介绍),端头A1-C-B1平面与A2-C-B2平面 互相正交。若A1≠B1且A2≠B2,则分子与其镜像不能重合,具有手性。但若端头A1=B1或A2=B2,则分子中将出现对称面,手性消失。
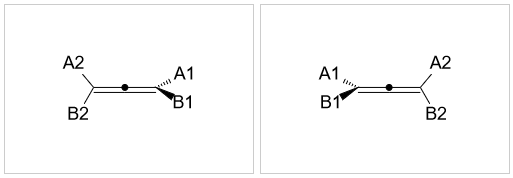
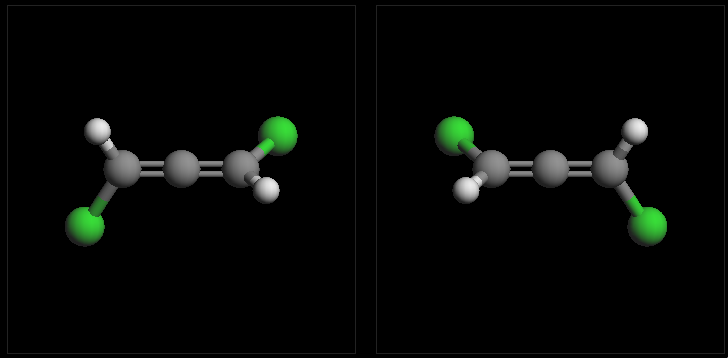
取代联苯
两个苯环之间通过一根单键相连,即构成了联苯。需要注意的是,联苯中两个苯环之间不存在共轭,中间单键就是一根可以旋转的σ键。 正常情况下,这根键旋转360度能垒不高,室温下可以完成。但若苯环相去较近的位置上连接有较大的基团(如下图),存在明显的空间位阻, 则旋转能垒大大提高,通常情况下中间σ键无法自由旋转一周。此外,由于空间斥力,我们也很容易想象两个苯环连同其连接的基团不会处于 同一平面上,总会错开一个角度(能量最低时两个苯环一般处于正交状态)。类似累积二烯,当两个苯环上连接的基团各不相同时,分子也将 具有手性。但反过来如果有一对取代基相同,则分子中又将出现对称面,手性消失。
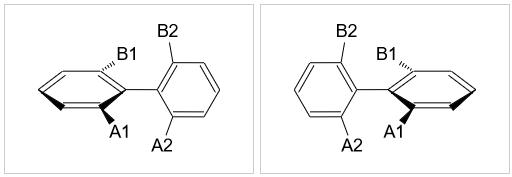
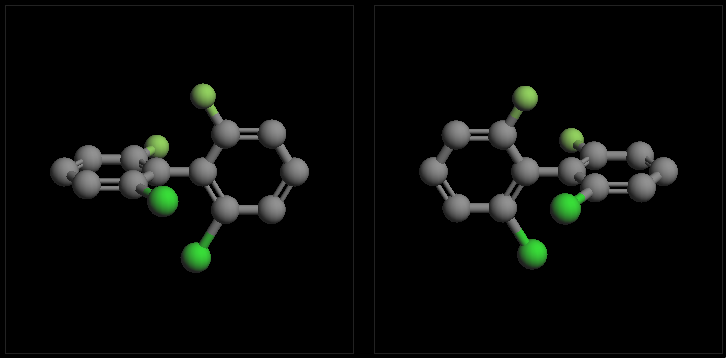
螺环衍生物
螺环烷烃是我们所熟悉的分子,两个环通过一个螺碳原子相连接。螺碳原子本身sp3杂化,因此其两侧的两个环——如下图中的四元、六元环—— 也不会处于同一平面上,而是互相正交。若左右两环上连接了两对各自不同的基团,类似前面累积二烯的倾向,手性又将出现。

注解
对于这些不具有手性中心的手性分子,如果大家在脑海中不易想象出它们的立体形状,可以参考如下地址的分子立体模型:
https://organic.cpu.edu.cn/~partridge/OrgChem/MolModels/enantiomers/mirrorViewer.html
在页面中可以选择不同的具备或不具备手性的分子,自己旋转一下模型,看能否把左右的实物与镜像在空间中重叠起来。
常见分子出现手性的规律
螺旋型与手性面类分子相对少见,我们可以姑且放在一边。观察具有手性轴的一系列分子,我们会发现,它们其实都有一个普遍的共性: 分子中存在非共面(一般是正交)的两个平面,这两个平面上又分布着不同的基团。
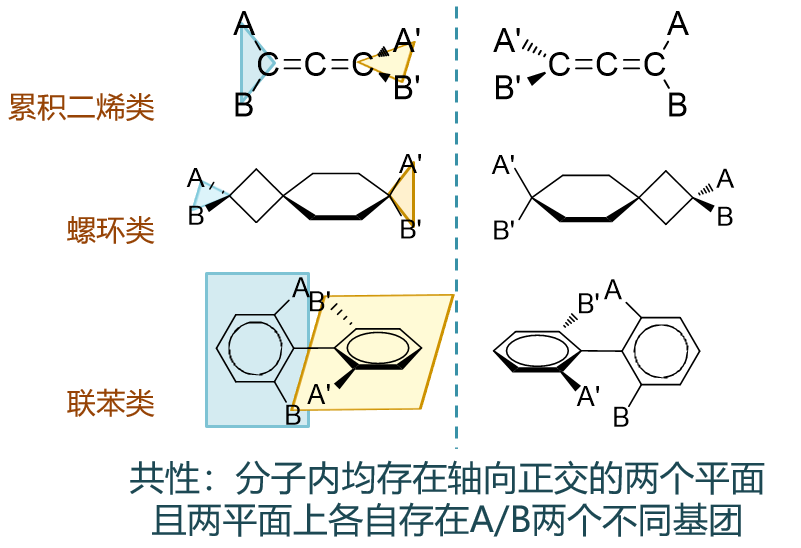
如上图所示,像联苯类的分子,左环与A、B构成一个平面(蓝色),右环与A'、B'构成一个平面(黄色),这两个平面正交。而若A、B及A'、B'各不相同, 分子将具有手性。
类似的,对于累积二烯,两根双键端头同样存在互相正交的A-C-B及A'-C-B'平面。若A、B及A'、B'各不相同,分子也将具有手性。
包括螺环衍生物也是如此。A-C-B平面与四元环垂直,四元环与六元环垂直,六元环又与A'-C-B'垂直,分子里其实有一系列垂直正交关系。我们易得 A-C-B与A'-C-B'平面也正交。
这个规律甚至不仅局限于手性轴类分子。我们最熟悉的具有手性中心的手性分子,某种意义上说,也满足这个共性。
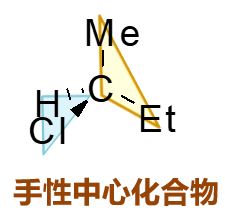
如上图中的单手性中心化合物,手性碳上连接了氢、甲基、乙基、氯四个不同的原子或基团。注意到中心碳原子sp3杂化,我们发现这里用蓝色标记的H-C-Cl平面 与用黄色标记的Me-C-Et平面也是互相正交的。又是有夹角不共面的两个平面,面上各自有两个不同基团。
总之,大凡在分子中看到这么一个典型的结构特征,我们基本就可以判断,该分子实物与镜像不能重叠,具备手性。
在日常练习或考试中我们也经常可以利用这个原则,以下试举数例:
- 例1
请判断如下分子有无手性。
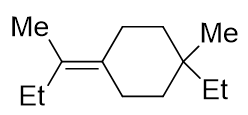
我们注意到分子中存在一根双键。单根双键,两端碳原子均为sp2杂化,与双键碳相连的原子或基团应当共面(注意与之前两根连续双键的累积二烯不同!)。 于是,左侧Me-C-Et平面、双键、双键右端六元环,这三个部分应当共面。于此同时,六元环最右侧Me-C-Et平面,明显与六元环本身正交。这么一来我们发现, 分子中左右的两个Me-C-Et平面互相正交,如下图所示。两个正交平面,平面上各自又分布着甲基、乙基两个不同基团,于是整个分子将具有手性。
- 例2
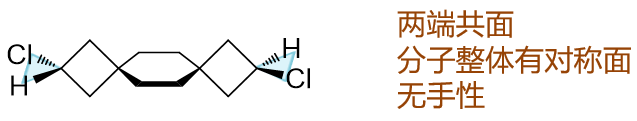
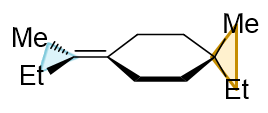
请判断如下分子有无手性。
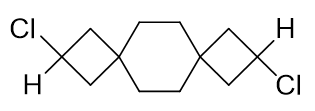
这也是个螺环衍生物,只不过有三个环,两个螺碳原子。我们依然可以分析分子内的一系列正交关系。最左端H-C-Cl平面与左侧四元环正交,左侧四元环与 中间六元环正交,六元环与右侧四元环正交,右侧四元环又与右端H-C-Cl平面正交。通过这么一系列正交关系,我们发现,当前左右两端的H-C-Cl平面, 实际是共面的。虽说两端侧链H与Cl不同,但由于共面,两端H-C-Cl所在的这个平面实际也是整个分子的对称面。分子自然也就不具有手性。