共轭二烯的亲电加成
共轭加成
共轭二烯——典型的如1,3-丁二烯(80版系统命名)/丁-1,3-二烯(17版系统命名)——发生亲电加成时,我们知道与普通烯烃存在明显区别,常具有两种主要的途径,1,2-加成或1,4-加成, 相应地生成两种可能的主要产品,如下图所示(此处与HBr加成)。
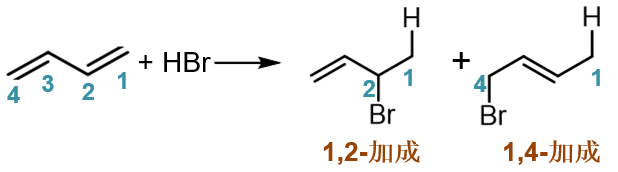
之所以出现这两种产物,我们知道,还是与反应机理有关。反应首先还是质子与双键碳成键,形成碳正离子。1,3-丁二烯中两根双键化学环境 相同,我们不妨设质子先与C1-C2间双键反应,根据马氏规则,将得到如下碳正离子:
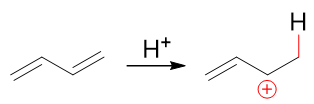
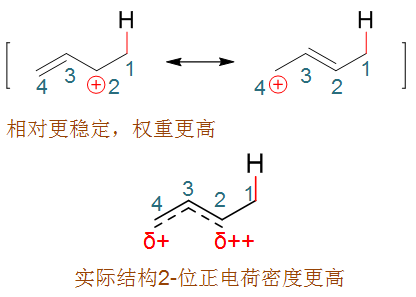
而该碳正离子明显正电中心碳可以与旁侧双键共轭,是一个电子离域体系。根据共振论的观点,我们可以用一对共振极限式的平均化来表达它的结构:
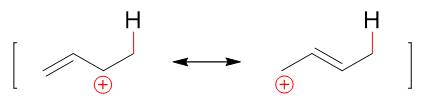
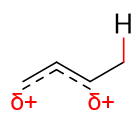
平均化后的实际结构大致如下图,原2-、4-位都会带有部分正电荷:
备注
关于共振论尤其是共振极限式的画法,请详见 重难点小结:共振论(1)。
既然这两个位置上都缺电子,接下来Br-的进攻自然存在两个可能的靶点,如下图所示。如果进攻2-位,某种意义上我们可以理解为与左侧的 共振式结构反应,则得到1,2-加成产物;反之进攻4-位,则相当于与右侧的共振式反应,将生成1,4-加成产物。
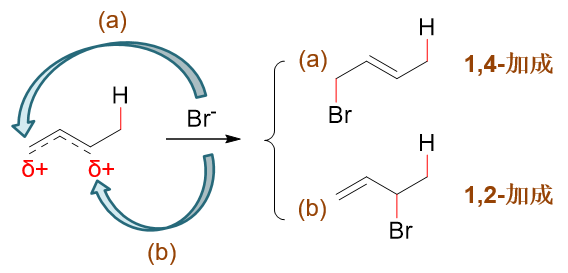
Br-的进攻自然存在两个可能的靶点
热力学控制与动力学控制
当然,我们也知道,1,2-与1,4-两种产品究竟谁占的比例更高,实际与反应温度有关。低温下将是1,2-加成为主;反之高温下则更容易发生1,4-加成。 之所以出现这么个情况,实际与反应的动力学特征及生成物的热力学稳定性有关。
首先,1,2-与1,4-加成,可以视作是一对竞争性的反应,而这两条反应途径的活化能是存在明显区别的。前面关于反应机理的讨论,我们 已经知道加质子后形成的碳正离子中,因为共轭,两个位置都带有部分正电荷,可以成为卤负离子进攻的靶点。而这两个位置上带的正电荷密度 实际存在差别——之前共振论的讨论里我们其实已经涉及了这个问题。如下图所示,由于左侧共振式的正电中心多连接了一个给电子的甲基,因此 稳定性要强于右侧的共振极限式,在做共振极限式的平均化时所占权重也相应较高。因此我们可以下结论,虽说这个正离子实际结构里2-、4-位 都带有部分正电荷,但2-位带的正电荷密度明显较高,更容易吸引卤负离子的进攻。换句话说,加成反应第二步,卤负离子进攻2-位发生 1,2-加成的活化能要低于进攻4-位的1,4-加成。
备注
关于共振式稳定性对实际结构的影响,详见 重难点小结:共振论(2)。
其次,我们再注意观察两种最终产物的结构,无论哪一种,分子内都还有一根双键。1,2-加成产品双键处于碳链端头而1,4-加成产物双键处于中间。 在烯烃稳定性的讨论里,我们也已经了解了一个较普遍的规律:一般双键上连接烷基数目越多,超共轭效应越明显,相应的烯烃稳定性也会越高。 就这一角度,明显1,4-加成产物的热力学稳定性应当较强,能量较低。
综合以上两点,我们其实可以定性地画出这一对竞争性反应的能线图了,大致如下图所示。中间是反应的起始状态, 碳正离子卤负离子开始接近,向左则是发生1,4-加成,向右1,2-加成。1,2-加成活化能(图中Ea1,2) 较1,4-加成(图中Ea1,4)来得低。而热力学能量上,1,4-产物又较1,2-产物来得低。
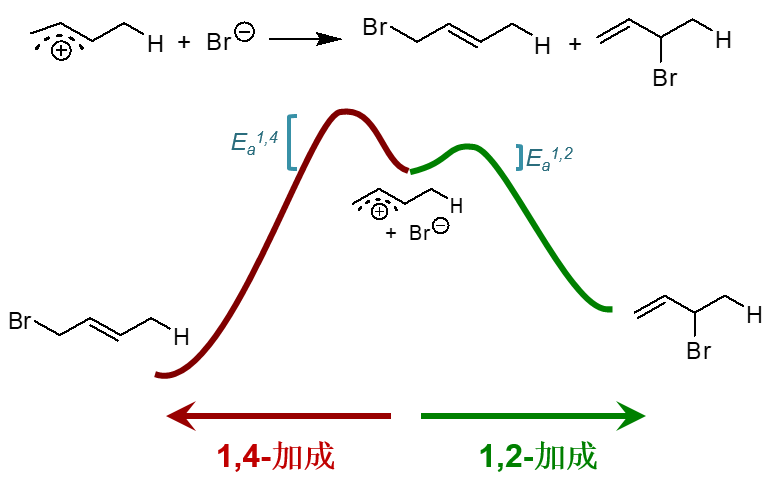
现在假设我们在较低的温度下进行反应。低温下我们知道,分子热运动能量比较低,打个不是特别恰当的比方,不是特别活跃不是特别能蹦跶。 在这种情况下,它能蹦跶过1,2-加成这个小坡就算不错了,而1,4-加成要克服的能垒Ea1,4显得有点儿难以逾越。 既然如此,1,4-始终翻不过去,只能跳过1,2-这边,毫无疑问,这时的主要产物将是1,2-加成的产品。
类似这样的情况,反应的主要产品由活化能决定,我们称其为“动力学控制”。
但反过来在高温下,情况大为不同。分子热运动能量大大升高,显得特别能蹦跶,不但翻过1,2-的活化能很轻松,1,4-的坡也不在话下。甚至 还远不止于此,生成产品之后,它还能往回翻,也就是发生逆反应,显得特别调皮。
备注
原则上,所有的化学反应都是可逆的,困难程度不同而已。
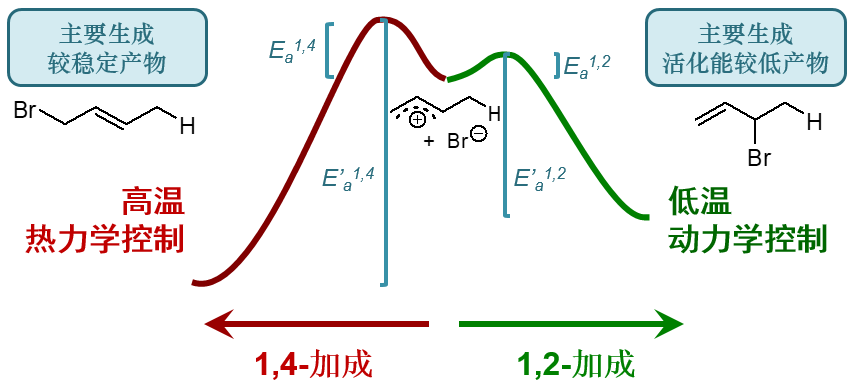
当然,1,2-与1,4-这两条路线如果真发生逆反应的话,逆反应的活化能也是明显不同的。1,2-这边正反应活化能低而产品热力学能量高,明显 逆反应的活化能要低于1,4-,这个坑比较浅。高温下发生1,2-加成后,整个体系相对比较容易又翻回来恢复成碳正离子与卤负离子的 初始状态。而1,4-加成这边,逆反应的活化能较高,或者说1,4-的这个坑比较深,分子翻过去之后再想爬出来就不是那么容易了。
一个坑易进易出,另外一个深一些,进去了就没那么容易出来,随着反应时间的推进,我们很容易想象,掉在1,2-这个坑里的分子将逐渐减少 而掉在1,4-坑里的将越来越多。
最终,高温下我们主要得到的将是1,4-加成的产物。这里主要产品由热力学稳定性决定,我们自然称为“热力学控制”。
备注
类似共轭加成这样,存在动力学/热力学控制的竞争反应还有很多。一般来说,高温、长时间反应容易导致热力学控制; 而低温、短时间反应容易发生动力学控制。
更复杂共轭烯烃的亲电加成
前面我们的讨论里使用的底物分子都是1,3-丁二烯(80版系统命名)/丁-1,3-二烯(17版系统命名),最简单的一种共轭二烯。但在实验室或是练习题中,我们经常也会遇到 更复杂共轭烯烃的加成。以下我们来讨论两个例子。
- 例:请写出2-甲基-1,3-丁二烯(80版系统命名)/2-甲基丁-1,3-二烯(17版系统命名)与HBr加成的主要产品。
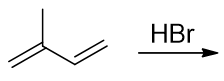
和1,3-丁二烯相比是多了一根侧链,情况略有不同。
我们还是从反应历程来考量。反应第一步还是质子加到双键碳上,但这里两根双键不对称。如下图所示,若质子先与右侧双键反应, 根据马氏规则,我们将生成上方的碳正离子;反之若质子与左侧双键反应,将得到下方碳正离子(注意这里都是遵循马氏规则的)。 明显下方碳正比上方稳定性更强,反应过程中主要也是生成底下这种碳正离子中间体。
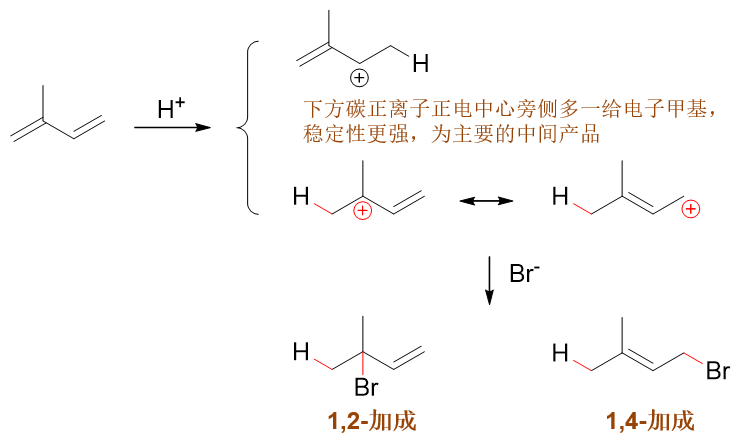
接下来下方这种碳正离子依然存在共轭结构,我们又可以继续写出它的两个共振极限式来,原先碳链的2-、4-位都带部分正电荷, 可能被卤负离子进攻。最终我们也是生成1,2-与1,4-两种加成产物。根据温度不同,主要产品也相应地发生变化。
- 例:请写出1,3,5-己三烯(80版系统命名)/己-1,3,5-三烯(17版系统命名)与HCl加成的主要产品。
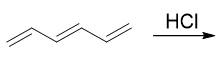
这次不是共轭二烯了,而是又多了一根双键,共轭三烯。
依然从机理入手,当前底物分子中存在两种化学环境不同的双键,第一步加质子可能形成两种碳正离子中间体。如下图所示, 如果质子先与中间双键反应,将得到上方的碳正离子;反之与两侧双键反应,将得到下方的碳正离子。上下方这两种碳正离子 正电中心碳与双键间都存在共轭。但上方,正电中心与左侧双键间隔开了一个sp3杂化的饱和碳,只有右侧 一根双键能参与共轭,形成三中心两电子的共轭体系。而下方,两根双键都能参与共轭,形成五中心四电子的共轭体系。一般来说 共轭体系越大能量越低,这里也是如此,反应过程中将主要生成底下这种中间体。
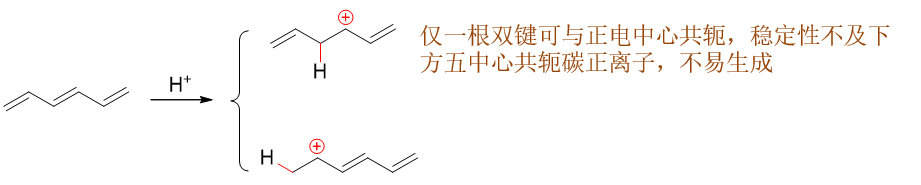
而下方这个存在共轭的碳正离子,根据共振论的观点人为地令电子对顺次发生转移,我们可以写出三个主要的共振极限式, 如下图所示。实际结构中也是三个原子上都会带有部分正电荷,都可能成为Cl-进攻的靶点,分别得到 1,2-、1,4-与1,6-加成产品。
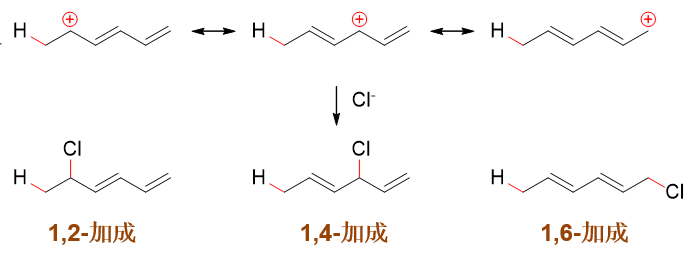
这三个产物中,相对而言1,2-与1,6-一般生成的会多些,而1,4-加成产物无论是高温还是低温,生成量都相对较少。 为什么会出现这个现象,有兴趣的话大家可以自个儿琢磨一下原因。