诱导效应与共轭效应、碳正离子的稳定性
诱导效应与共轭效应,是两种基本的电性效应,影响着基团旁侧位点的电子云密度。 在烯烃这一章中,这两种效应是我们判断碳正离子稳定性时的主要依据。后面章节的一些场合,这两种效应也能够帮助我们对反应活性等其它特性进行判定。
诱导效应
诱导效应(Inductive effect)相对简单,主要和原子的电负性有关。基团诱导效应的大小、方向大致可以这么来理解(注意这不是严格的定义,只是帮助理解):
在有机分子中,最常见的原子是碳与氢,最多见的共价键是C-H键;
于是我们就视C-H相连为标准状态,以这个状态下碳原子的电子云密度为基准值;
如果有原子/基团A的吸电子能力比H强(一般来说电负性较H更高),则这个原子/基团和C相连成C-A键时,即相当于将C-H标态中的H替换为A, 无疑会使得C上电子云密度较基准值下降,我们称之为吸电子诱导效应(-I);
反之,如果有原子/基团的吸电子能力比H弱(一般来说电负性比H更低),则这个原子/基团和C相连时,无疑会使得C上电子云密度较基准值升高,我们称之为给电子诱导效应(+I);
备注
注意,这里给/吸电子能力是与H,而非C比较。
究竟哪些基团具有给电子诱导效应,又有哪些具有吸电子诱导效应呢?我们这儿也有个简单的判别原则:在有机化学常见的基团中,具备给电子诱导效应的基本就是烷基。 而其他基团,尤其是杂原子为首原子的基团,由于杂原子电负性高于氢,基本都是具有吸电子诱导效应的,如下表所示:
效应 |
基团 |
|---|---|
+I |
-R(烷基) |
-I |
-X、-OH、-OR、-NH2、-NO2、-SH、-SR、-CX3等 |
当然我们也很容易想象,杂原子的电负性越高,对应的基团吸电子诱导效应也会越强,如:
(-I) -F > -Cl > -OH > -NH2
此外诱导效应也还与原子的杂化形态有关。从sp3到sp2到sp,s的成分逐渐增加,杂化轨道也越来越具有s轨道的特征,距原子核距离越来越小, 这使得原子核对电子的束缚能力逐渐增强,换而言之原子核吸引电子的能力增大。如同样是烃基,吸引电子的能力大致有如下次序:
-CH2CH3 < -CH=CH2 < -C≡CH
因此,碳原子sp2杂化的烯基与sp杂化的炔基,通常情况下我们也都认为是具有-I效应。
在我们当前的烯烃一章中,尤其是在亲电加成反应的讨论里,基团的诱导效应很显著地影响了碳正离子中间体的稳定性。 正电荷碳周边连接给电子诱导效应的基团,基团往中心碳那侧推电子,能使正电荷得到一定程度的分散,整体稳定性会上升。 反之若连接具有吸电子诱导效应的基团,基团反过来还把电子往自己身边拉,使得中心碳原子上越发地缺电子,整体稳定性自然会下降。
基于以上的讨论,我们也就很容易判定出,以下的一系列碳正离子的稳定性有如下的次序:
Me3C+ > Me2C+H > MeC+H2 > Cl3CC+H2
共轭效应
共轭效应(Conjugated effect)较诱导效应略微复杂一些,它涉及原子间离域的大Π键的形成,涉及多个p轨道侧面的交叠。它对碳正离子稳定性的影响, 从某种意义上说要比诱导效应更显著。
我们不妨先来看个简单的例子,请比较如下两个碳正离子的稳定性(正丙基碳正离子、烯丙基碳正离子):MeCH2-CH2+、CH2=CH-CH2+。
前者看起来带电荷中心碳原子旁侧是个乙基,我们已经知道,它具有+I给电子诱导效应,可以使中心碳上电子云密度略有升高,正电荷一定程度得以分散, 整体稳定性上升。后者碳正旁侧则是连接了乙烯基,依据我们之前的讨论,乙烯基应当有一定的-I吸电子诱导效应。两相比较似乎应当是前者稳定性更强。
但事实恰恰相反,后者稳定性实际要比前者强。这正是由于共轭效应的缘故。
我们回过头再仔细看一看后一个碳正离子,也就是烯丙基碳正离子的结构。其中左侧两个双键碳,我们很熟悉,都是sp2杂化, 各有一个没参与杂化的p轨道侧面交叠成键,没问题。
而第三个碳原子,也就是碳正离子中心原子,它其实也是sp2杂化。三根sp2杂环轨道分别与两个H及左侧的乙烯基 形成三根σ键,于此同时,它也存在一根未参与杂化的p轨道,当然这个轨道上没有电子,是个空轨道,但也毕竟是个轨道杵在那儿。
我们很容易想象,碳正上的这个空的p轨道,在空间上其实也可以与双键的p轨道互相平行,于此同时,它距离双键p轨道也并不遥远。 你双键碳俩p轨道能侧面交叠在一起,我这第三个p轨道,事实上也具备和你俩侧面交叠的能力。于是烯丙基碳正离子的实际结构中, 这三根p轨道就完全平行,连成一体,如下图所示:
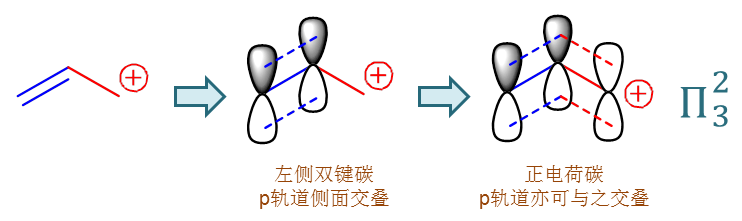
类似这种多个原子间的p轨道侧面交叠形成一个整体的现象,我们就称之为“共轭”。两个p轨道侧面交叠我们知道形成的是所谓 的π键,现在多个交叠,仿佛是π键的一个扩大化,我们就称之为大Π键。像上面烯丙基碳正离子形成的这个大Π键,总共是三个原子 三个p轨道,也就是三个中心,而其中有一个是空的p轨道,另两个双键碳的p轨道上各有一个电子,加一块儿两个电子,因此我们可以将这个 共轭的大Π键体系描述为Π32,读作“三中心两电子大Π共轭体系”。
这种大Π共轭体系多个p轨道实际会交叠成一个整体,几乎不分彼此,而原本p轨道上的电子可以在这个整体——也就是整个共轭区域自由流动。 正常情况下我们知道一根共价键一对电子,通常是位于两个原子之间的,分布范围比较局限,我们经常称之为所谓的“定域”。而现在共轭体系 形成之后,p轨道上电子一下子可以在多个原子之间广泛地流动,分布区域一下子扩大很多,我们经常称之为所谓的“离域”。 这种电子的离域分布带来一个特性,我们其实也很容易想象,它会使得整个共轭体系中各个原子上的电子云密度在一定程度上平均化。 像这儿的烯丙基碳正离子,从结构式看似乎一个正电荷就分布在最右侧这一个碳原子上,但因为共轭,形成了Π32, 粗略里看共轭体系里每个原子大概能平均分到2/3个电子,正电荷相当于被大大地分散开来了,每人都带一点儿。这种分散程度明显 较诱导效应的影响强得多,因而实际烯丙基碳正离子的稳定性将大大高于正丙基碳正离子:
MeCH2-CH2+< CH2=CH-CH2+
备注
我们这儿只是一个粗略的算法,帮助大家理解。实际在烯丙基碳正离子体系中,电子云的分布并不是完全平均的,中间2-位碳上 电子云密度较高,而端头1-、3-位电子云密度较低。包括其它很多共轭体系,电子云的分布也都不完全是均匀的。但不管怎么说, 共轭体系总会带来比较强的电荷分散的效果。
备注
这里我们看到,形成共轭之后,会使得碳正离子的稳定性很大程度上得以增强。不但对于带电荷的体系是如此,即便是电中性的分子,共轭体系的 存在往往也能使整个分子体系能量下降,稳定性提升。
在烯丙基碳正离子中的这个共轭体系,整体上相当于乙烯基那侧分担了大量的原本中心碳上的正电荷,或者换一个观点,相当于乙烯基 通过共轭将电子推向了中心碳原子。这种效应我们称为“给电子共轭效应”,简记为“+C”。当然,后面的学习中我们也能见到 相反的情况,共轭的基团反而会吸引电子,我们称为“吸电子共轭效应”,简记为“-C”。
备注
不论是+C还是-C,一般情况下对电子云密度的影响程度都要高过+I/-I。 但这个事儿也并不绝对,后面的章节里我们也会遇到诱导效应强于共轭效应的实例——但这种情况很少很少。
另外刚才我们在烯丙基碳正离子中,看到的是碳正离子中心原子上单个p轨道与碳碳双键π键的p轨道之间共轭。这种情况相当多见, 我们常称为“p-π共轭”。
当然,共轭体系还存在其它的样式。如下一章中我们会接触到的一个典型的二烯类的分子,1,3-丁二烯: CH2=CH-CH=CH2。从经典结构式看,似乎它是左右两根双键外加中间一个单键。 但如果仔细考查它的电子轨道情况,我们发现,分子里所有的碳原子实际都是sp2杂化,于是所有四个碳原子上的p轨道 都能侧面交叠成一个整体,形成一个四中心四电子的大Π共轭体系,如下图所示。这种共轭仿佛是由两个或多个间隔的π键 形成,因此被称为“π-π共轭”。
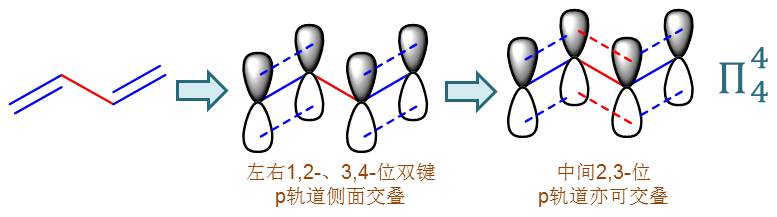
当然,大家一般情况下也不用在意p-π、π-π这些类型,反正只要在分子中看到有独立的未参与杂化的p轨道(换句话说有sp2、sp杂化的原子) 连续地挨在一起,通常都能够形成共轭体系。
备注
注意这里我们用了“通常”一词。并不是所有的sp2、sp原子相邻都能形成共轭的,典型的如联苯分子,两个苯环之间不存在共轭。 但绝大多数情况下,由于能够有效地降低整个分子体系的能量,多个连续p轨道总是倾向于相互平行,形成共轭体系。
共轭与诱导,这两种电性效应极大地影响着分子、离子体系中的电子云密度。而在基础有机化学中,我们接触的大多数比较重要 的反应又都是电性反应,与电子云密度实际有着直接的联系。因此随着学习的深入,大家会逐渐体会到这两种效应更多的应用。