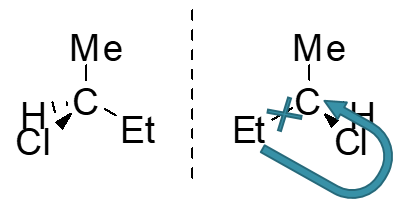立体化学一章中的一些概念
立体化学基础这一章很考验大家的立体想象能力,整个内容围绕着分子的构型展开,也涉及了不少与立体形态有关的概念。 这里我们对一些相对重要的概念做一个复习。
- 手性:
实物与其镜像不能在空间上重合的性质。人的左右手就是很好的例子,故而得名手性。
- 手性分子:
很直白,具有手性的分子。手性在分子世界广泛存在,大量的有机化合物都具有手性。
- 对映异构(旋光异构):
手性分子的特性,它的空间镜像结构与自身不能重合,实际是另一个分子。这种同分异构现象即称为对映异构。一对对映异构体构造上完全相同,只是构型不同。
- 手性中心:
分子中连接四个不同原子/基团/孤对电子的四面体中心。最常见的是手性碳,sp3杂化,周边连接的四个原子/基团构成正四面体。四面体的四个顶点皆不相同。 除此驻外,有机分子中还能见到手性氮、磷、硫等原子。
备注
手性中心与分子手性没有必然的关联性,既非充分也非必要条件!有手性中心不一定是手性分子(如内消旋体); 手性分子也不一定有手性中心(如轴手性、面手性化合物)。这两者之间的关系大致如下图:
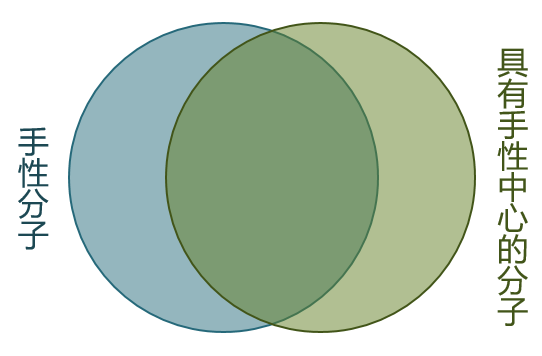
但在我们当前学习的基础有机化学中,绝大多数手性分子都具有手性中心,基本都落在上图两个集合的交集中。
- 外消旋体:
手性分子一对对映异构体的等量混合。注意外消旋体一定是混合物。如下图为一对外消旋体:
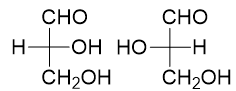
含有单个手性中心的分子一定存在一对外消旋体。一对外消旋体的手性中心构型一定各自相反,如上例中左为R,右为S。
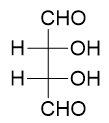
- 内消旋体:
含有多个相同手性中心分子的特殊情况。分子内两个手性中心的旋光程度相同方向相反,刚好互相抵消,导致分子整体无旋光性。 此外,内消旋体结构上一般也存在着对称面。
与外消旋体不同,内消旋体是单一的分子,不是混合物。下图是一典型的内消旋体,分子内部两个相同的手性中心构型也相反(R、S):
- 非对映异构:
含有多个相同手性中心分子的特殊情况。两个分子构造相同,仅有手性中心构型不同,但互相之间并非实物与镜像关系。如下图中一对分子:
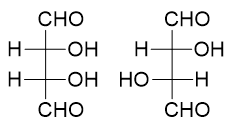
一对非对映异构体各自的手性中心不会全同,也不会全反,如上例中左为(2R,3S),右为(2R,3R)。非对映异构体的物理性质(熔、沸点等)往往也存在较大的差异。
- 构型异构与构象异构:
都是立体异构中的子集,构型或构象异构体的构造式都完全相同,只是立体形态有差别。
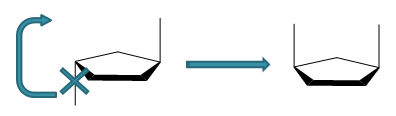
构象异构与分子中σ键的旋转有关,每转过一个角度,分子的立体形象都会发生改变,与原先的形象在空间上无法重合,严格意义上说也就算是同分异构体了。 但由于σ键的旋转的能垒不高,分子在室温下很容易克服,因此构象异构体一般难以分离,我们在基础有机化学中也不是特别重视。当然在特别低的温度下有可能 分离构象异构体。如在绝对零度附近,可以将丁烷的对位交叉式与邻位交叉式分离。
构型异构则由于分子中原子/基团空间相对位置的不同引起。一对构型异构体的转化必须通过化学键的断裂与重新组合才能完成(如下图), 能垒很高,室温下不能进行。因此通常情况下构型异构不难分离开来,我们也必须加以区分。