重难点小结:不同结构羧酸的酸性比较
羧酸名字里就带个酸字儿,当然是典型的具有酸性的有机化合物。不同结构羧酸酸性强弱的比较,也是基础有机化学学习过程 中的一类常见问题。处理这类问题,依然还是我们之前的惯用做法,考查质子解离后形成的负离子的稳定性。
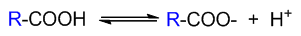
对于羧酸而言,形成的羧酸根负离子稳定性无疑会受到旁侧基团的影响。一般来说,旁侧基团R吸电子能力越强,越能帮助羧酸根 上负电荷的分散,形成的负离子也就越稳定,解离平衡越向右偏,该羧酸的酸性也相应地越高。反之若旁侧基团R给电子能力 越强,越不利于羧酸根负离子的稳定,该酸的酸性也就越弱。
至于旁侧基团的给、吸电子能力,实际受到很多因素的影响。在基础有机化学中,我们一般只考虑其中最基本的因素: 电性效应(包括诱导效应与共轭效应)。
以下我们来看一些典型示例。
- 示例:请比较以下化合物的酸性强弱。
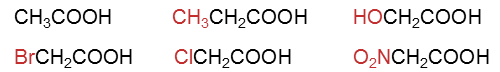
这一系列化合物结构相仿,我们可以都将其视之为乙酸的衍生,一个新基团取代了乙酸α-位的氢原子:
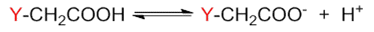
如前所述,只需考查这个基团的电性效应,即可判断该羧酸的酸性强弱。需要留神的是,当前在取代基团Y与羧基之间隔开了一个 sp3杂化的饱和碳原子,因而Y与羧基包括羧酸根之间不可能形成共轭体系。换而言之,Y的共轭效应不会对负离子的 稳定性造成影响,这里我们只需要考虑它的诱导效应。
单就诱导效应而言,明显甲基是+I,推电子,这将导致丙酸的酸性较乙酸要弱些。其余的-OH、-X、-NO2,由于 杂原子的电负性较强,都是-I吸电子,因而相应的取代羧酸酸性都将强于乙酸。此外-I吸电子的能力上明显有 -NO2> -Cl > -Br > -OH的次序,由此这些取代羧酸的酸性高下也就不难判断:
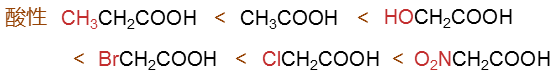
注解
常见的一些基团诱导效应强弱大致如下图所示:
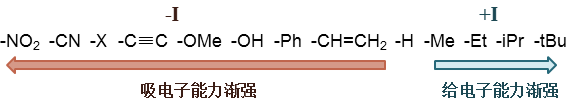
示例:请比较以下化合物的酸性强弱。
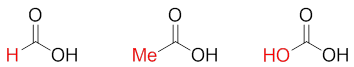
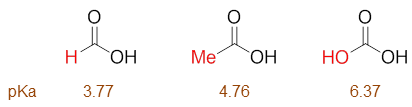
第三个分子实际是碳酸,但某种意义上,我们也可以将其视为羟基取代的甲酸。于是这三个分子也都具有甲酸母核,区别无非就是 羧基碳上连接的基团(-H、-Me、-OH)不同。
按惯例,我们还是考虑取代基团的电性效应。对于乙酸而言,取代的-Me就是很单纯的诱导给电子+I,因此不难判断,它的酸性 将较甲酸为弱。至于碳酸,-OH诱导效应上无疑还是吸电子-I。但与前例不同,这里我们注意到羟基与羧基直接相连了(而不是 中间隔开了饱和碳)。不难发现,从取代的羟基到右侧羧基,其实是可以形成共轭体系的,因而这里羟基的共轭效应将对羧基 产生影响。羟基共轭时会提供一对电子,无疑具有给电子共轭效应+C。而且对于一般的杂原子基团,我们也知道通常共轭效应会 大大强于诱导效应,整体上羟基在这里是个很强的给电子基团(+C >> -I),给电子能力也比乙酸中的甲基高得多,相应地, 碳酸的酸性也就要弱于乙酸不少:
- 示例:请比较以下化合物的酸性强弱。
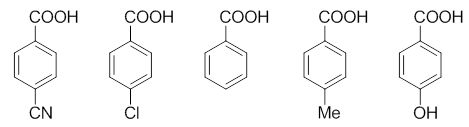
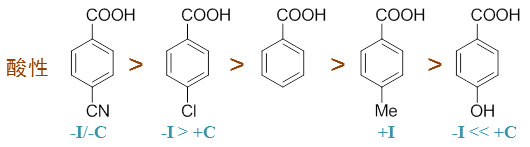
这是一系列结构类似的取代苯甲酸,取代基均处于羧基对位,我们依然可以利用基团的电性效应来判定其酸性强弱。
首先所有这些取代基团的诱导效应显然会影响羧基;于此同时,从取代基到苯环到羧基也可以形成大共轭体系,且取代基 刚好处于羧基的对位,因而取代基团的共轭效应(如果存在的话)同样也会对酸性造成影响。
如对甲基苯甲酸中的甲基,无法参与共轭也没有共轭效应,诱导效应单纯的+I,因而酸性上应较苯甲酸为低。
而对羟基苯甲酸,羟基+C >> -I,整体上是个很强的给电子基团,给电子能力远强于甲基,这导致它的酸性也较苯甲酸弱不少。
至于对溴苯甲酸,溴的诱导效应-I,共轭效应+C。但卤素原子与其它饱和杂原子不同,-I会略大于+C,因此溴这里整体上 是个比较弱的吸电子基团,对溴苯甲酸的酸性也略高于苯甲酸。
最后对腈基苯甲酸,诱导效应-I;共轭上,由于腈基中C、N均只各出一个电子参与共轭,没有多给,且又都是sp杂化,对 电子的束缚能力强于sp2杂化的苯环、羧基碳,因此具有挺强的-C效应。两相叠加,这几个取代基团中就 以它的吸电子能力最高,相应的,对腈基苯甲酸的酸性也就最强。
注解
对羟基苯甲酸中的酚羟基实际也具有一定的酸性,但其酸性远弱于羧基,因而这里基本可以将其忽略。
- 示例:请比较以下化合物的酸性强弱。
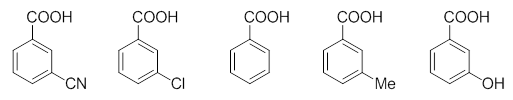
与前例类似,但将各取代基团从羧基对位移至间位。
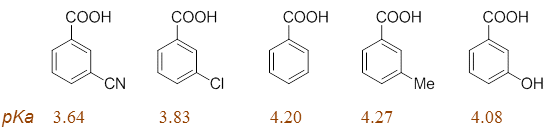
无论取代基在何位置,其诱导效应的倾向不会有太大改变,但反过来共轭效应受位置的影响要大得多。对苯衍生物而言, 取代基团共轭效应影响比较大的是其自身的邻、对位。相反,取代基团的间位,则几乎不受共轭效应的影响。因此, 我们不难发现,这里的一串分子,羧基将基本感受不到取代基团的共轭效应,各分子的酸性基本也只与取代基的诱导 效应相关。由此,我们也就不难理解这一系列分子实测的pKa值了:
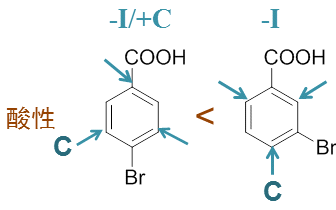
- 示例:请比较对溴苯甲酸与间溴苯甲酸的酸性强弱。
同样的,而间溴苯甲酸影响羧基的基本只是-I,而对溴苯甲酸中羧基可以同时感受到溴的-I、+C两种效应,两者部分抵消, 因此间溴苯甲酸的酸性将高于对溴苯甲酸:
注解
取代苯甲酸酸性的比较其实与取代苯酚中的类似问题如出一辙。可进一步参阅 重难点小结:取代苯酚的酸性。
在取代苯甲酸中,有一种比较特殊的情况是邻位取代衍生物。实验中发现,羧基邻位如若有取代基团, 不论该基团电性效应是给电子还是吸电子,往往都会使得这种取代酸的酸性较单纯的苯甲酸来得更高(所谓的邻位效应):
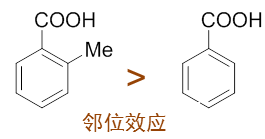
这可能源于两个基团相对较近的位置。除电性效应外,位阻、分子内氢键等多种其它因素这里也会影响到羧基的酸性。 由于情况复杂,基础有机中我们对其也不作过多讨论。