利用定位规则合成苯衍生物
在化工与药物生产活动中,经常需要合成一些多取代的苯衍生物。而这类分子的合成通常都与苯环亲电取代的定位规则有关, 各个基团按什么样的次序引入苯环,引入过程中是否需要进行必要的官能团转换,都是值得斟酌的事儿。
在这里我们由易到难,来考查合成中的一些实例。其中部分示例使用了我们当前还比较陌生的反应,随着学习的逐渐推进, 大家可能会有更深的体会。
- 例1:请由苯出发合成间硝基氯苯。
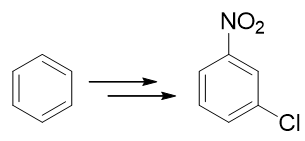
硝基与卤素原子,分别可以通过硝化与亲电卤代反应引入芳环。这里只需要稍微留意一下先后次序。
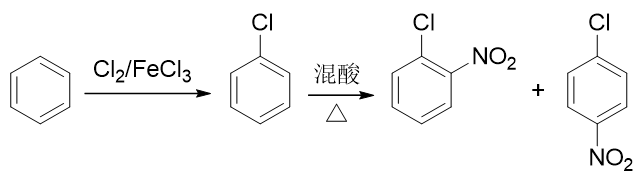
如果先做亲电卤代,从苯合成氯苯,再进行硝化,则由于卤素原子是特殊的吸电子邻对位定位基,最终主要产品将是 邻硝基氯苯与对硝基氯苯,与合成要求不符:
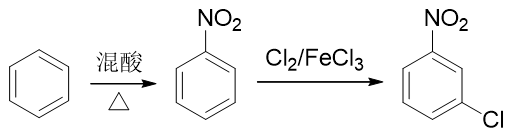
因此我们只能颠倒次序,先进行硝化,制备出硝基苯。硝基刚好是间位定位基,接下来做卤代即可以大量生成目标分子:
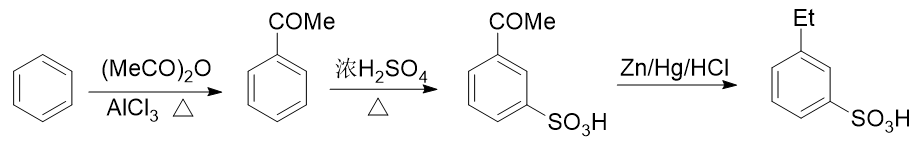
- 例2:请由苯出发合成间乙基苯磺酸。
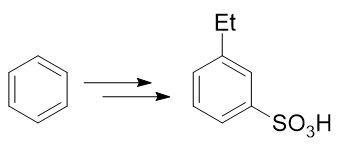
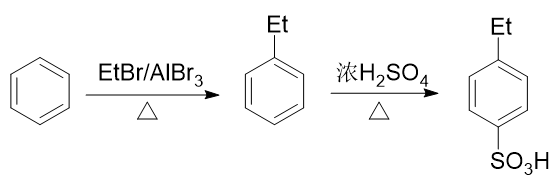
苯环上需要引入磺酸基、乙基两个基团。前者自然可以使用浓硫酸磺化,后者也很容易让我们联想到傅克烷基化反应。
如果先做傅克得到乙苯,乙基是个邻对位定位基,接下来磺化时无疑无法大量生成间位取代产物:
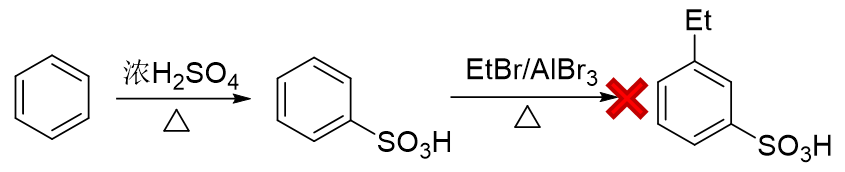
而反过来先磺化生成苯磺酸,看起来似乎磺酸基是个间位定位基,再来烷基化,乙基刚好可以进入磺酸基间位。但千万 别忘了傅克反应对芳环上电子云密度有比较苛刻的要求,当前苯环上连接磺酸基这么一个较强的吸电子基,傅克反应 实际上难以发生:
无论先上哪个基团都不成,看起来似乎有点儿山穷水尽的意思。但在合成中我们其实可以稍微灵活些,不同的基团间 实际是可以相互转化的。比如目标分子中的乙基,在有机合成里其实很容易从乙酰基(-COMe)转化过来。在后面醛酮 一章中我们会接触经典的Clemmenson还原反应,使用锌汞齐在酸性环境中可以把羰基还原成烷基:
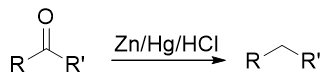
也就是说,如果使用这个反应,目标分子其实可以来自于间乙酰基苯磺酸:
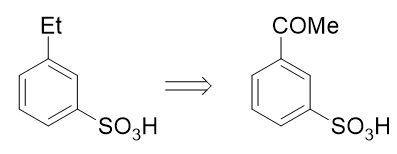
而看到间乙酰基苯磺酸,大家立马就能找到思路了:先通过傅克酰化引入乙酰基,乙酰基刚好是间位定位基,再磺化,两个 基团都能就位。于是我们可以写出如下的整条合成路线:
备注
利用Clemmenson还原,将酰基与烷基联系起来,是合成中常见的一个技巧。尤其是涉及苯衍生物的合成,由于 傅克烷基化容易发生重排、多取代等副反应,为了追求较高的产率,即便是制备烷基苯,我们也经常会使用先酰化再还原的手法。
- 例3:请由苯胺出发制备邻硝基苯胺。
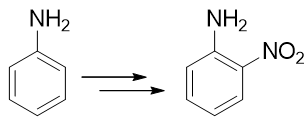
本例看起来很简单,氨基恰好是个强给电子的邻对位定位基,似乎直接混酸硝化就能生成产品。但真这么做的话产率一般不会高。 很重要的一个原因是由于氨基的强给电子能力,这导致苯胺的苯环上电子云密度特别高。一般电子云密度越高的地方越容易 被氧化,考虑到混酸里硫酸、硝酸都具有比较强的氧化性,很可能我们希望的亲电取代还没发生,苯胺就已经被氧化掉了。
因此在合成时,我们需要尽力去避免这样的氧化反应的发生。怎样避免也有个挺常见也挺直白的做法:既然苯胺是由于环上电子云 密度过高导致容易被氧化,我们只需要试着稍稍降低环上的电子云密度,它的抗氧化能力应该就会增强。实验室中为了达到这个效果, 经常使用乙酰氯或者乙酸酐先把氨基转变成乙酰氨基(这个反应我们在后面羧酸衍生物、含氮化合物这两章中会详细介绍):
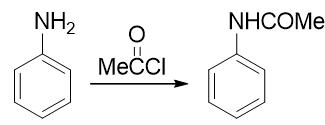
乙酰苯胺相当于是我们在氨基旁侧又接上了一个吸电子的乙酰基。这首先会使氮原子上电子云密度有所下降,进而会使苯环上 电子云密度也没有苯胺那么高,抗氧化能力大大增强,基本不会再为混酸所氧化了。当然,乙酰氨基整体上依然还是具有给电子 效应的,依然也还是个邻对位定位基,定位性质上与氨基一般无二。
但由于乙酰氨基体积远大于氨基,这又导致了一个新问题。我们接下来如果直接进行硝化反应,受位阻的影响,硝基将主要进入 乙酰氨基的对位,而不容易进入我们预期的邻位:
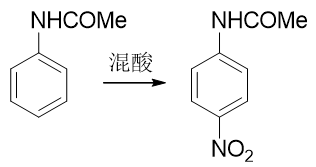
这个事儿看起来有点儿棘手。但合成里处理这种问题我们又有一个比较通用的手段:可以别着急硝化,先利用其它的 亲电取代反应,在对位引入某个容易上去也容易下来的基团;接下来再硝化,这时由于对位已经被其它基团占据了,硝基 无处可去,只能进入乙酰氨基邻位;最后,再设法去除对位的占据基团,合成目标就可以达到。这种在苯衍生物合成中 常见的手法我们常称之为“占位”。而最适合进行对位占位的,是我们熟悉的磺酸基。通过浓硫酸磺化,磺酸基很容易上去, 而只需要在稀酸性条件下水解,磺酸基也很容易从芳环上脱下来。能上能下,能屈能伸,磺酸基的这个特性很容易让我们写出 如下的合成路线来:
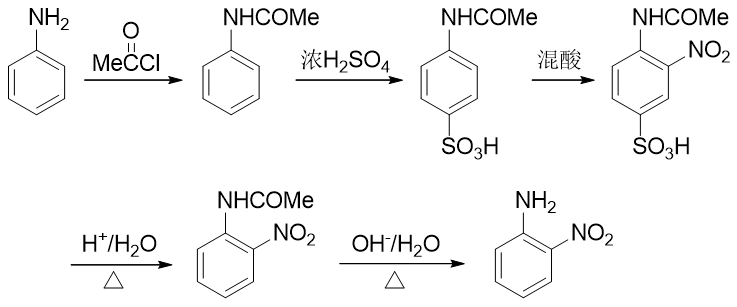
当然稀酸水解脱除磺酸基后,我们还需要把之前的乙酰氨基恢复成氨基。这里一般碱性条件水解就行(酸酸衍生物一章中我们 会详述酰胺这类分子的水解)。
备注
本例中的酰化保护氨基、磺酸基占据对位都是在合成中常见的技巧,大家一定需要掌握。
- 例4:请由苯胺合成间溴苯胺。
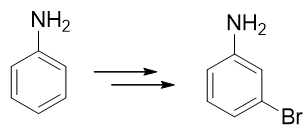
还是与苯胺有关,当前我们的目标是再引入一个溴原子——这当然需要利用亲电卤代反应。比较麻烦的是,这里氨基明显是邻对位 定位基,直接溴代位置不对。即便我们采取前例的做法,把氨基转化成乙酰氨基,依然改变不了它的定位位置,同样也行不通。
因此这提示我们,需要对氨基进行性质转化,使其转变为吸电子的间位定位基才成。如何转化其实异常简单:苯胺这类有机胺类 化合物的性质与无机氨相仿,也具有碱性(当然苯胺这样的芳胺碱性比无机氨要弱一些)。因此在较强的酸性环境下,苯胺的 氨基可以接受一个质子,转变成铵正离子:
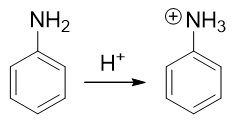
转成铵正离子后,氮原子上直接带了正电荷,必然不可能再向苯环那边推电子了。相反,这种正离子一般都是极强的吸电子基团, 肯定是间位定位基,我们可以如愿进行卤代:
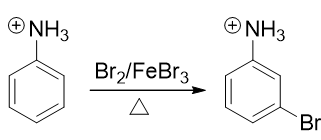
最后在碱性环境下,把铵正离子恢复成氨基结构,合成就此完成。整条路线大致如下:
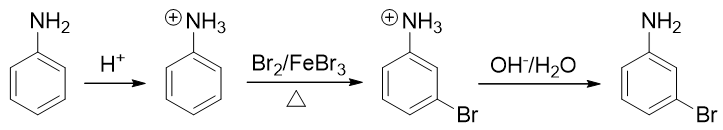
备注
本例中的目标产物间溴苯胺,如果从苯出发制备其实更简单,有成本更低的手段。后面硝基化合物一章我们会接触相关的反应。
- 例5:请由邻甲氧基苯酚出发合成5-硝基-2-甲氧基苯酚(80版系统命名)/2-甲氧基-5-硝基苯酚(17版系统命名)。
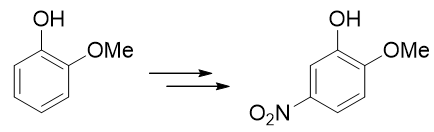
本题只需要再引入硝基这一个基团,但直接硝化明显不太合适。注意到当前苯环上已有的羟基、甲氧基都是给电子的邻对位定位基, 而且二者定位位置刚好不一致。这种情况下我们也知道,亲电反应的主要位置将由更强的给电子基决定(这里是羟基)。因此 如果一上来就硝化,硝基将主要进入羟基的邻对位,而无法大量得到进入甲氧基对位的目标产品。
因此这暗示我们,还得对既有基团事先做一定的转化。一个比较容易想到的思路是:既然当前羟基给电子能力更强导致得不到目标产品, 我们可以把羟基转变成一个给电子能力弱于甲氧基的新基团,接下来再硝化,硝基就可以就位。要让羟基做这种转变,合成里一个 常见的方法其实也是酰化(与之前我们看到的苯胺的例子类似)——将羟基转变成酯基:
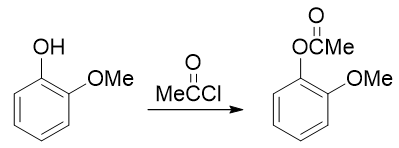
注意醇羟基酯化我们可以使用羧酸的酯化反应,但酚羟基不行,通常需要用到活性比羧酸更高的酰卤或者酸酐。这个反应我们在后面的 醇酚醚一章将会接触。
转成酯基后,相当于羟基氧旁侧接了一个吸电子的酰基,整体给电子能力将明显弱于甲氧基了。我们接下来放心进行硝化,硝基可以进入 预期位置:
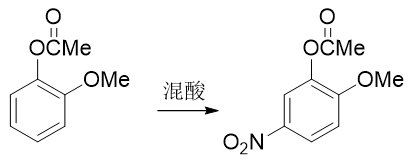
最后还得把酯基恢复成羟基。这个反应我们也不陌生:酯水解就成。酯水解通常在碱性条件下进行,而酚羟基酸性不弱,此时会得到苯氧基负离子。 最终还需要酸化使之恢复成酚羟基
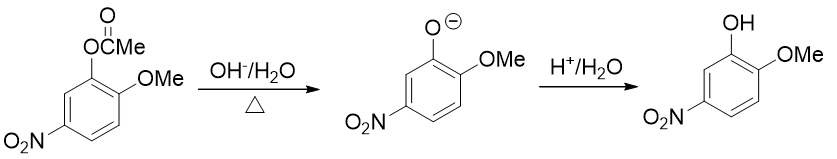
整个合成路线如下图所示:
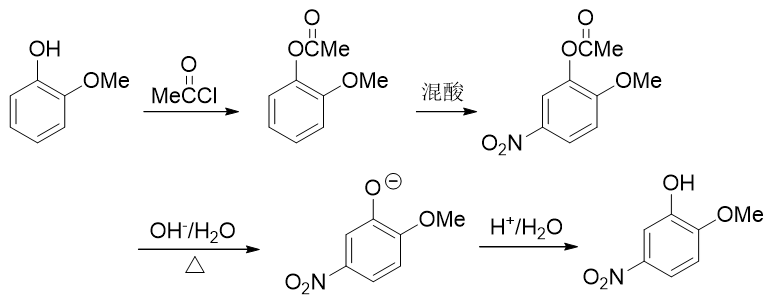
总之,苯衍生物的合成中,为了在苯环上引入新基团,我们经常会使用亲电取代反应。而大凡使用亲电取代,请一定注意定位规则,必要的时候需要对 基团进行转化,改变它的给/吸电子能力。