Hückle规则
芳烃一章中,我们接触到了所谓的“芳香性”——某些具有特定结构的高度不饱和环状化合物特殊的稳定性。 它大致有四方面特征:
环结构上存在共轭的不饱和键(一般是双键)
但却不易发生类似烯烃的加成与氧化反应
相反更易进行亲电取代
此外相对于开链共轭结构热力学稳定性更强
芳香化合物中总是有环,最常见的就是苯环,除此之外多个苯环可以稠合形成萘、蒽、菲这样的稠环芳烃。 当然我们也知道,某些环状化合物与苯无关,甚至模样长得奇形怪状,但偏偏也具有(一定的)芳香性——这类分子我们称为“非苯芳烃”。
在目前的学习阶段,我们无需过多关注非苯芳烃反应性质,但必须掌握判断非苯芳烃的方法,也即大名鼎鼎的“Hückle规则”。 这是判断共轭环系有无芳香性的一个经验规则,言下之意不是特别精密特别完备,但已经能够满足一般情况下的使用需求。 规则基本有三条,满足如下三个条件的环系即具有芳香性:
成环原子共平面
形成共轭回路
环上π电子总数4n+2
条件1看着最简单,但很多情况下我们在纸面上其实不好判断。一般可以从条件2、3入手,满足2、3,一般来说1也是成立的。
条件2形成共轭回路,意味着环上原子所有通常均需sp2杂化(偶有sp杂化,但极少见),有垂直于环可参与共轭的p轨道。从分子的纸面结构上, 我们一般能够比较轻松地判断出此条件是否满足。
条件3最为显眼,要求共轭体系中离域电子总数满足4n+2(n为非负整数)。这需要我们能够计算出环上单个原子参与共轭p轨道上电子的数目, 最后进行加和。应用Hückle规则最大的难点可能也就在这里。
参与共轭单个原子p轨道电子数目的计算
好在在基础有机化学的学习中,我们接触到的分子通常都还比较简单,参与共轭的电子数目也不难计算。前面讨论取代基对芳环上亲电取代反应 活性、定位影响时,我们已经涉及到了共轭体系电子数目的计算。这里再归纳、复习一下。
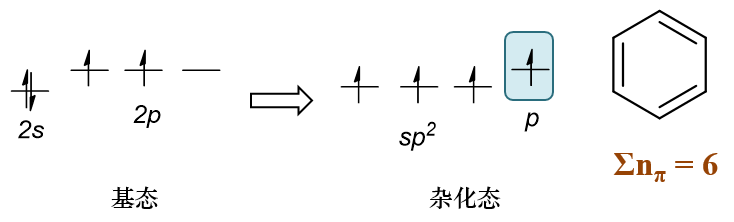
sp2杂化碳原子,nπ = 1
其外层电子在轨道中的分布情况如下图所示,p轨道上未成对的单个电子参与共轭。譬如像苯,环上六个碳原子均为sp2杂化, 共轭体系π电子总数6个。
sp2杂化杂原子(O、S、N等),分两种情况
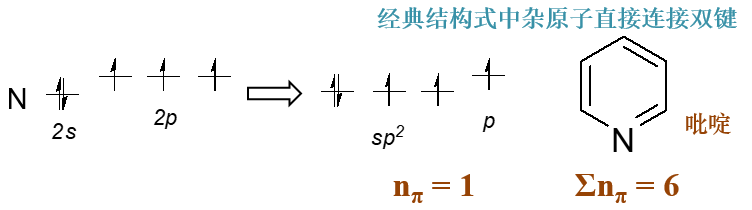
若经典结构式中杂原子直接连接双键,则nπ = 1
如下图中吡啶分子中环上的氮原子,其外层五个电子在轨道中分布如下,p轨道上也是一个电子。连同环上另外五个sp2杂化 碳原子,整个共轭体系π电子总数6个,具备芳香性。
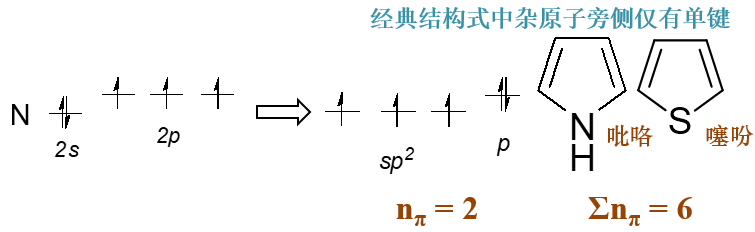
经典结构式中杂原子旁侧仅有单键,则nπ = 2
如下图中吡咯分子中环上的氮原子,其外层五个电子在轨道中分布如下,p轨道上会排布一对电子。连同环上另外四个sp2杂化 碳原子,整个共轭体系π电子总数也是6个,同样具备芳香性。其它如下右的噻吩,情况也是类似。
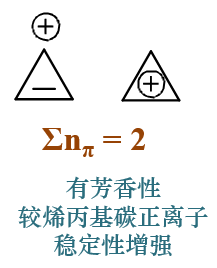
若原子上带有电荷,则π电子数目较中性原子相应增减,但单个原子π电子数目总在0-2范围之内
这也很容易理解。如我们熟悉的碳正离子,sp2杂化,可以参与共轭。相对于电中性的碳原子,碳正少了一个电子, 丢失的这个电子其实就是来自于参与共轭的p轨道,因而碳正在参与共轭时提供0个电子。
类似的像碳负离子,多了一个电子,这个电子无处可排,也只能挤在p轨道里与原先的一个电子配对,于是共轭使可以提供2个电子。
此外,通常单个原子只能提供一根轨道参与环上的共轭,其π电子数目不会超过2,也当然不会小于0。
比如下图中左侧的环丙烯碳正离子,三个碳原子明显都是sp2杂化可以形成共轭回路,三个碳也肯定共面, 计算π电子总数,两个双键碳每人一个电子,碳正中心0个,加一块儿2,刚好是4n+2中n=0的情形。因此别看这个 分子又是张力大又是带电荷,偏偏它还具有一定的芳香性。此外由于共轭的缘故,正电荷其实也不是集中在最上方 的碳原子上,而是被整个环系均分,因此书写结构的时候,我们经常画成下图中右侧的样式,中间一个圈儿。这个 圈儿是芳香性的体现,也暗示了环上所有原子的等性。
再如下图中的环戊二烯负离子,环上各碳原子也都是sp2杂化可以形成共轭回路。四个电中性碳每人出一个π电子, 碳负出两个,凑在一块儿六个,于是它也具有芳香性,加上整个分子特别匀称,负电荷被整个环均分,书写结构的时候它也享受了画圈儿的待遇:
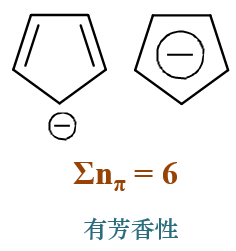
掌握了这三条规律,计算共轭环系中的π电子总数一般也不是难事,再结合Hückle规则中的另两个条件,我们就可以对环系芳香性的有无下结论了。
单环体系的判断
- 例1:如下四个环状分子或离子,请判断其芳香性的有无。
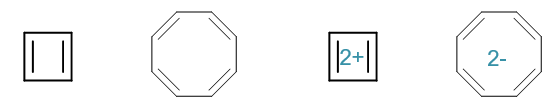
正如我们之前所提到的,Hückle规则中的共面条件从纸面上一般不太容易判断,因此我们姑且先放到一边,先判断是否可能有共轭回路 及π电子数目是否为4n+2。若满足后两个条件,则共面条件通常也会满足。
首先,该系列分子、离子环上均为碳原子,且原子均为sp2杂化,因此都具有形成共轭回路的可能性(注意是可能性,而非一定形成共轭回路)。
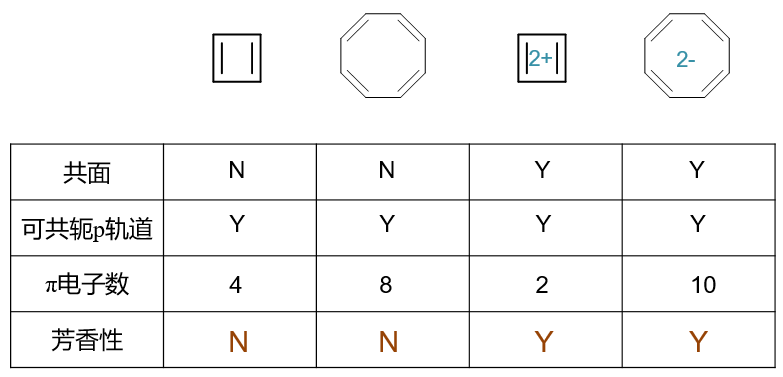
其次计算共轭的π电子总数(如果共轭回路的话)。第一个分子环丁二烯,四个sp2杂化碳原子每人一个π电子,总数是4, 明显是4n,不满足规则,因此不具有芳香性。类似的,第二个分子环辛四烯,π电子总数是8,也不具备芳香性。
但后两个离子情况发生了变化。环丁二烯二价正离子,带两个正电荷,相当于有两个碳原子各缺一个电子形成碳正离子,只提供空p轨道,我们再计算 π电子总数就变成了2,刚好是n=0的情形。因此相对于环丁二烯,这个二价正离子的芳香性反倒增强了。
最后的环辛四烯二价负离子也是类似的情况,相当于两个碳原子转变成碳负离子,各提供2个π电子,最终共轭电子总数变为10,满足规则, 也就具有了一定的芳香性。
这四个分子、离子的情况总结如下表:
备注
由于不具有芳香性,事实上环丁二烯与环辛四烯环上原子并不共面,也无法形成共轭回路。而它们的二价正、负离子反而空间上反而会转变为平面结构。
- 例2:如下三个杂环分子,请判断其芳香性的有无。
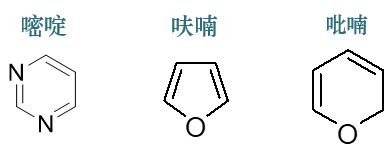
除碳原子外,这三个环上都有杂原子参与共轭。计算π电子数时需考虑杂原子周边的成键情况。
嘧啶中两个氮原子均与双键直接相连,各提供一个π电子,连同剩余四个sp2杂化碳,环上π电子总数为6,具有芳香性。
呋喃中氧原子旁侧只有单键,共轭时提供两个π电子,连同剩余四个sp2杂化碳,环上π电子总数也为6,具有芳香性。
吡喃中氧也是提供两个π电子,再加上四个双键碳,似乎π电子总数亦为六个。但注意环右下角存在一个sp3杂化碳, 该原子无法参与共轭,换而言之这个分子的共轭体系没有形成回路,是链状的。无疑这不满足Hückle规则的条件2,因此整个分子不具备芳香性。
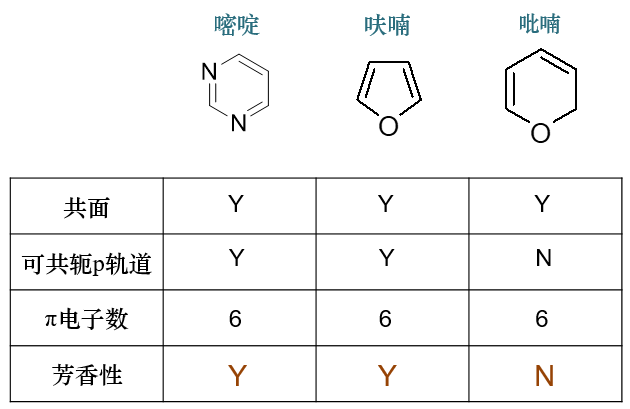
单环体系的特例:轮烯
所谓轮烯,指的是如下类型的分子:
单环
具有偶数碳原子
经典结构式环上单双键间隔分布
像我们前面例子里的环丁二烯、环辛四烯,乃至于苯,都可以归于轮烯之列。
轮烯中所有碳原子经典结构式上均与双键直接相连,因此均为sp2杂化,具备形成共轭回路的可能性。但值得特别注意的是, 并非所有的满足4n+2条件的轮烯都具有芳香性。
典型的如下图中环上十个碳原子的[10]轮烯,看起来就像是萘环少了中间的稠合边。
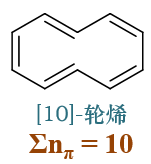
该分子若形成共轭则π电子总数为10,满足4n+2。但注意到分子中间两个碳原子之间距离很近,且各自连接了一个氢原子(如下图左所示), 如果整个环处于同一平面的话,这俩氢原子将紧紧地挤在一起,斥力过大。因此该分子实际空间结构从侧面看大致如下图右,环会出现扭曲, 保证两个氢原子能够错开。既然环上原子并不共面,整个分子自然也就不具有芳香性。
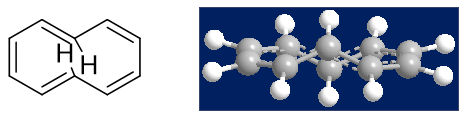
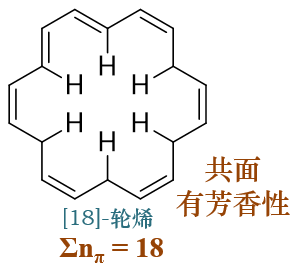
但更大的[18]轮烯情况有所不同,如下图所示,环足够大,明显指向环内部的氢之间距离足够远,斥力也不大。因此整个环可以保持 共面的状态,加之18个π电子满足4n+2,因此该分子将具有芳香性。
介于这两者之间的[14]轮烯,环基本共面,但指向环内部的四个氢原子也较为接近,存在一定的斥力,导致环出现一定的扭曲。 目前大家公认的结论是这个分子具备一定的芳香性,但芳香性并不强。
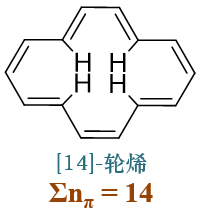
在轮烯结构的基础上,有时我们还能见到一类变形分子。如在[10]轮烯基础上衍生出的下图中的结构,中间两个碳上不再连接有氢, 而是连接同一个亚甲基:
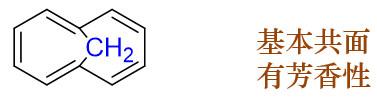
之前[10]轮烯,中间这俩碳原子之间那点儿空间需要塞进去两个独立的氢原子,斥力极大。而当前这个分子,俩碳原子之间只需塞进去 另外一个原子了(亚甲基中的碳,注意亚甲基中的氢原子与环并不共面,并不存在多少斥力),位阻情况明显好上很多。因此这个变形的分子 环上十个碳原子反而基本能处于同一平面上,也就具备一定的芳香性了。
稠环体系的判断
含有稠环体系的分子,结构中会存在多个环系(各自的小环、外圈的大环等)。严格意义上说,芳香性是针对某个特定环的,但很多情况下(尤其是习题、考试中) 经常会要求大家笼统地判断整个分子有无芳香性。如遇到这类问题,大致可采取如下做法:
先判定最外圈大环有无芳香性
若大环无芳香性,再针对各小环判定
各环中只要有一个芳香环,则可认为是具有芳香性的分子(这条实际并不一定准确,只是在目前阶段大致可以如此简化处理)
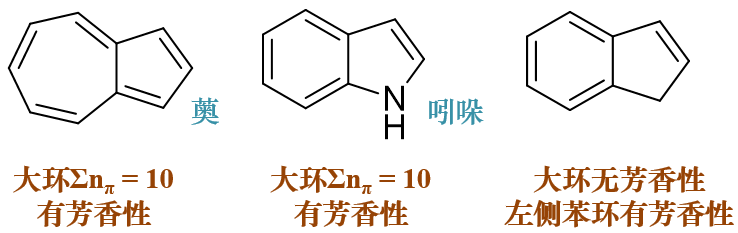
- 例3:请判断如下三个分子有无芳香性。
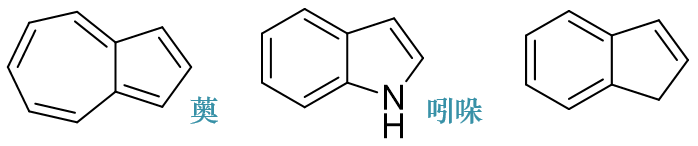
这三个分子都是两个小环共用一条边形成的稠环体系。依据前述的原则,先大环再小环我们挨个儿判断。
第一个分子薁,大环上所有十个原子均为sp2杂化,可以形成共轭回路。每个原子一个π电子,共轭体系电子总数为10,刚好均有芳香性。
第二个分子吲哚,外圈大环八碳一氮,均为sp2杂化,可以形成共轭回路。结构式中氮原子旁侧均为单键,提供两个π电子,共轭体系电子总数为10,也具有芳香性。
第三个分子,外圈大环九个原子,注意到其中右下角碳原子明显是sp3杂化,这导致大环中无法形成共轭回路。单就最外圈大环而言, 它并没有芳香性。
大环没芳香性也不碍事儿,我们再考查分子中的小环。注意到左侧六元环明显是苯环,依据上述的第三条判据,这个分子我们也姑且认定它也具有芳香性。
备注
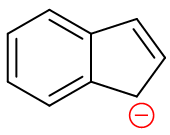
上图中的第三个分子俗名茚,在化学反应中,实际更为引人注目的是它较强的酸性。换句话说直接反应的话通常很难体现出芳香性来, 往往首先发生的是五元环sp3杂化碳上的质子脱除,形成如下的负离子。而这一负离子中,最外圈大环、左侧苯环、 右侧环戊二烯负离子环均具有芳香性,稳定性相当高——这也是茚酸性的缘由。
环外双键的处理
在判定芳香性时还有最麻烦的一种情况:在环外还有其它原子通过重键(一般是双键)连接环上原子,此时原则上说这个环外原子也可以参与共轭体系。 撞上这类分子在应用Hückle规则的时候我们需要做一个特殊的处理:人为令环外双键中π键一对电子转移到某一个成键原子上,写出双键变单键电荷分离的共振式, 而后在此无环外双键的共振式结构基础上进行判断。
- 例4:请判断环丙烯酮分子有无芳香性。
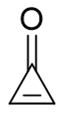
上图中分子,三元环最上方的碳原子通过一根环外双键连接了氧原子,欲判断该三元环有无芳香性,我们需对此双键进行前述的处理, 写出电荷分离的共振式。注意到这里氧原子电负性远较碳高,因此为了追求稳定,我们令双键里π键一对电子转移到氧上, 如下图所示,此时双键变单键氧带负电荷而碳原子带正电荷。
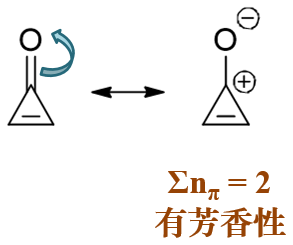
写出上图中右侧的共振极限式后,我们注意到这个极限式里已经不存在环外双键了。接下来环外原子一律不管,单看三元环。环上两个电中性sp2杂化 碳外加一个正电荷碳,实际类似环丙烯正离子的情况,π电子总数为2,该分子将具有一定的芳香性。
- 例5:请判断如下分子有无芳香性。
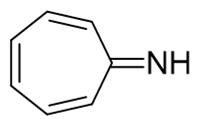
与前例类似,存在一根环外C=N双键。判断芳香性时我们也一样将其拆开,令一对电子转移到氮原子上得到右侧的共振极限式。 右侧极限式中环上六个电中心碳外加一个碳正,刚好也是6个π电子,具有一定的芳香性。
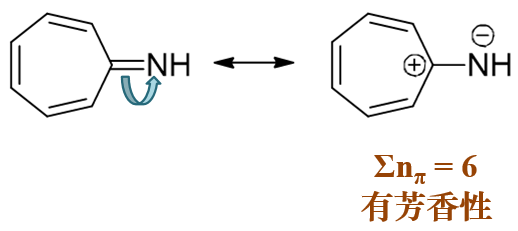
- 例6:请判断如下分子外圈大环有无芳香性。
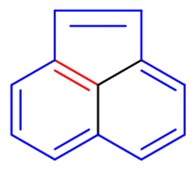
该分子相对复杂,是全由碳原子构成的三环稠合的体系,现要求判断最外圈11个碳原子形成的大环(图中用蓝色标记)芳香性的有无。 注意到当前经典结构式中红色的那根双键明显不在外圈大环上,当然也算是环外双键。判断芳香性时我们又得把这根双键拆开。
之前的两个例子都是碳与杂原子形成的双键,由于电负性的差异,电子转移时的方向非常明确。现在这根环外双键处于碳原子之间, 两端电负性相同,略微有些疑惑,究竟这对电子向何处转移呢?
一时确定不了方向其实也没太大关系,我们把两种可能的情况都画画看。如果环外双键上一对电子转移至外侧(左上角碳),我们将 得到下图中间的共振极限式。反之如果转移至内侧(中心碳),我们将得到下图右侧的共振极限式。如此一来我们得到了两个满足无环外双键条件 的共振极限式。
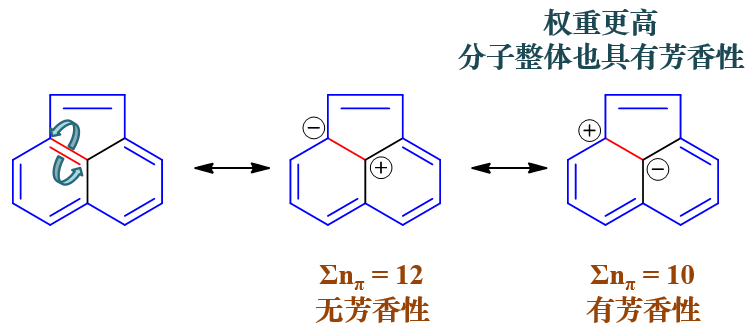
这两个共振式我们分别判断。中间这个外侧碳上带负电荷,提供两个π电子,连同其它十个电中性碳,外圈环上总共是12个共轭电子,应当不具有芳香性。
而右侧共振式,外侧碳上带正电荷,提供0个π电子,连同其它十个电中性碳,外圈环上总共是10个共轭电子,应当又具有芳香性。
这下看起来有麻烦了,一个共振式有芳香性,一个又没有,彼此矛盾。那究竟有没有芳香性呢?
答案是有。原因也很简单,我们经过之前共振论的学习,知道分子实际结构是共振极限式的平均化,而各共振极限式平均化时的权重又与其稳定性相关。 而具有芳香性的共振极限式,明显稳定性要强于非芳香性的电荷分离式,权重自然来得更高。换句话说整个分子的实际结构其实更加接近于具有芳香性 的极限式。因此类似这种情况,两个看起来差不多的电荷分离式,其中只要有一个满足Hückle规则,整个环系也将具备一定的芳香性。