习题讲解:烷烃与环烷烃
本章内容相对简单,在线习题的难度也不算大,但错误率不低。大家在线学习时请一定注意细节, 遇到不太明白的地方一定多讨论,多沟通。
总分 |
13 |
平均分 |
7.91(60.8%) |
最高分 |
13(100.0%) |
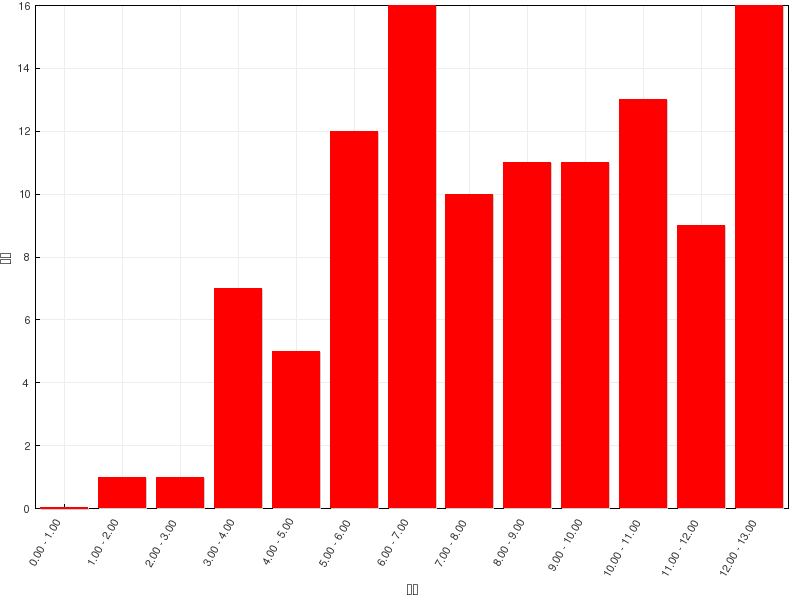
成绩分布
这里稍稍讲解一下在线习题中错误率较高的,以及课本习题中相对比较有意思的题目。
在线习题
- 题2:命名(错误率58.0%)
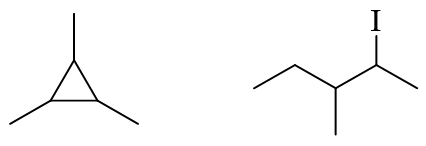
严格意义上是个环烷烃(有个小三元环),但环特简单而链特复杂,因此这里明显应反其道而行之,以最长碳链作为母体,按开链烷烃的原则进行命名。
最长碳链的编号方式,无非从左向右(棕色)从右向左(绿色)两种,如下图:
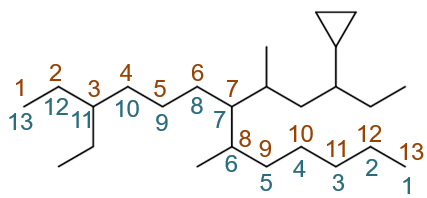
这两种编号方式侧链取代基分别在3,7,8-位与6,7,11-位,明显应当取前者,自左向右的编号。3-位乙基、8-位甲基都好办,7-位有一个比较大的 复杂取代基,没法儿直接称呼出来。按照系统命名法的原则,把这个取代基单抽出来,从与母体相连的碳开始,找一条最长碳链并编号,如下图:
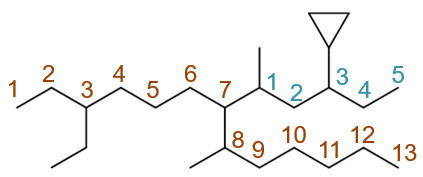
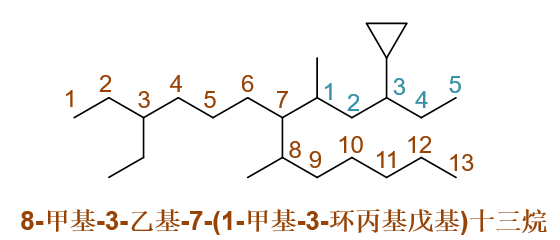
易得此复杂取代基应称为1-甲基-3-环丙基戊基。最终整个分子命名为:8-甲基-3-乙基-7-(1-甲基-3-环丙基戊基)十三烷。注意 这里列出取代基的次序:先小后大。
- 题3:命名(错误率63.4%)
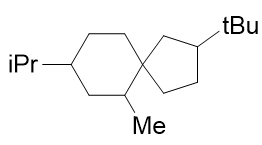
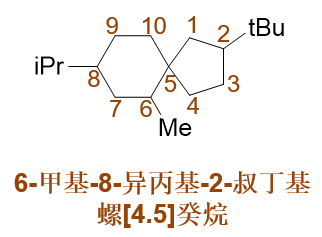
典型的取代螺环烷烃。固定的编号原则:从小环螺原子旁侧的原子开始,绕小环一周至螺原子,再绕大环一周。 满足这一原则的前提下,尽量使取代基位次较小。对于这个分子,明显应当取如下编号方式:
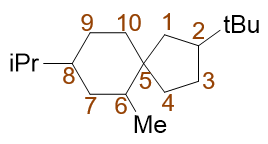
注意这里5-6的编号。小环编完,进入大环时并无方向上的要求,向左上或向左下走都可以,但需满足取代基位次最小的原则。 事实这两个环并非在同一平面,而是互相正交,这种编号的随意性也就不难理解了 (详见 立体化学一章重点小结:无手性中心的手性分子 )。
最终,整个分子名称为:6-甲基-8-异丙基-2-叔丁基螺[4.5]癸烷。 各取代基仍旧需要按优先级从小到大列出。此外,方括号分隔数字的应是点号而非逗号。
- 题4:命名(错误率65.2%)
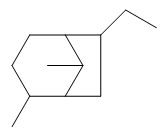
典型的取代桥环烷烃。这类分子依然有固定的编号原则:从某一桥头碳开始,先沿最长边至另一桥头碳,再顺次走过次长边,最后是最短边。 满足这一原则的前提下,同样需要尽量使取代基位次较小。于是我们易得如下的编号方式:
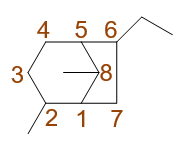
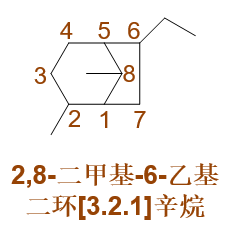
最终,整个分子命名为:2,8-二甲基-6-乙基二环[3.2.1]辛烷。
注解
烷烃的命名是整个有机化合物系统命名的基础。关于命名的更多讨论,请见 重点小结:系统命名 。
- 题7:排序(错误率25.9%)
请按沸点由高至低顺序排列下列化合物:
3,3-二甲基戊烷
2-甲基己烷
正庚烷
正戊烷
开链烷烃的熔沸点变化非常有规律,尤其沸点。一般来说,碳原子数目越多、分子量越大的烷烃,由于分子间范德华力增强,沸点会越高。而 同碳数的烷烃,通常支链越多,分子间距离增大,沸点会越低。
依据这两个原则,回头看这四个分子,A、B、C都是七碳,D是五碳,因此D的沸点应当最低。至于A、B、C,分子量相同而支链数目不同。 我们易得这四个分子沸点由高至低次序应为:C > B > A > D。
- 题9:排序(错误率55.4%)
请按熔点由高至低顺序排列如下化合物:
2,2-二甲基丙烷
2-甲基丁烷
戊烷
和前一题有点儿类似,只不过考察的是熔点而非沸点。基本规律还是相仿:分子量越大一般熔点越高、同分子量支链越多一般熔点越低。但需要特别 留神,对于某些对称性特别好的多支链烷烃,其分子晶体内晶胞可以堆积地更紧密,熔点反而要比直链烷烃来得更高。本题中A就是典型的这么一个 对称性特好的分子。因此本题答案应为:A > C > B。
注解
关于烷烃的熔沸点的更多讨论,尤其对称性对熔点的影响,请见 重点小结:开链烷烃的物理性质 。
- 题10:反应(错误率44.6%)
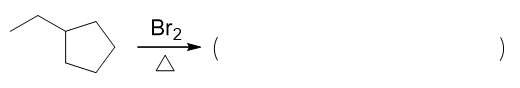
环烷烃与溴加热条件下的反应。不少同学认为会开环,发生加成。但注意到底物分子中是个比较稳定的五元环,除非在特别高的温度下,否则这个环不容易打开。 因此实际进行的主要反应,是加热条件下溴生成自由基,而后引发自由基卤代。
确定了基本的反应走向后,我们还需要解决一个问题:底物分子中有一大堆化学环境不同的氢,这里溴究竟主要会取代哪一个。这个问题其实也很明晰,我们知道 自由基卤代时,三种氢的活性规律是叔>仲>伯,尤其溴代选择性较高,三种氢的活性相差更为悬殊。因此咱们这儿确定,主要取代的一定是整个分子里 唯一的一个叔氢。于是得到解答:
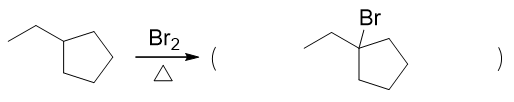
注解
看到有同学提交的答案里产品中有好些个溴原子,觉得自由基溴代时会不会出现多取代的产物。 这里答案实际是肯定的,该反应总会有多溴代产品生成。但平时练习或者考试时,如果没有特别指出反应物的量的话, 我们一般认为这两者就是1:1的反应,也就是认为主要发生单次取代。类似这样的反应题,我们只需要写出主要产物就成, 次要或者副产物通常都不用多管。
- 题11:反应(错误率35.7%)
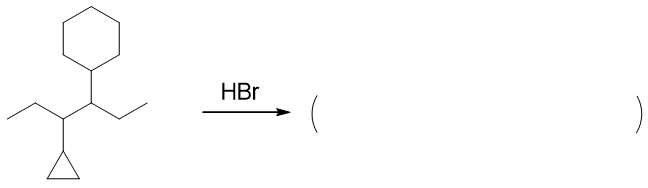
和前一题有点儿类似,又是环烷烃,这次是与HBr反应,而且是在常温进行。常温下,尤其HBr分子,一般不会产生卤素自由基了,我们这儿确定,一定发生的 是开环加成。
底物分子中两个环:三元与六元。六元环又是比较稳定,常温下一定不会发生变化,这儿肯定是小环三元环打开。主要产品的断键方向,包括H/Br各自加成的位置 皆遵循马氏规则,我们将得到如下结果:
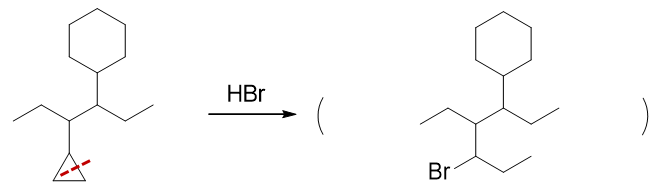
- 题12:反应(错误率45.5%)

催化氢化反应。明显,这里稳定的五元环还是不发生变化,依然是小三元环开环。值得注意的是,小环烷烃催化氢化时断键方向基本没有区域选择性, 叔碳与仲碳间、仲碳与仲碳间的共价键断开均有可能,各自生成的产品量都不少,需要全部写出(本题也是特地给了两个空)。

注解
关于小环烷烃的反应,尤其是一系列开环反应的详细讨论,请见 重点小结:小环烷烃的反应 。
课本习题
- 第二章习题2(9):命名
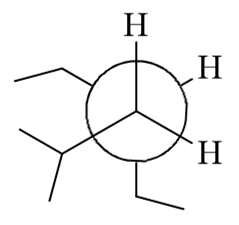
简单的开链烷烃的命名,只不过题干给了一个纽曼投影式,如果大家觉得看不清楚,可以先转化成更清晰的锯架式:
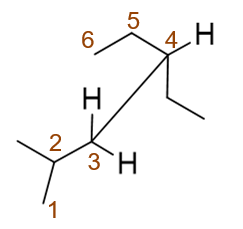
整个分子应称为:2-甲基-4-乙基己烷。
- 第五章习题4(1):反应
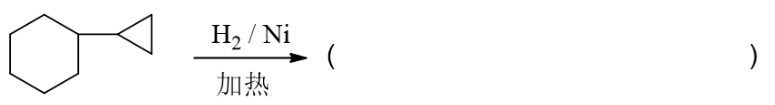
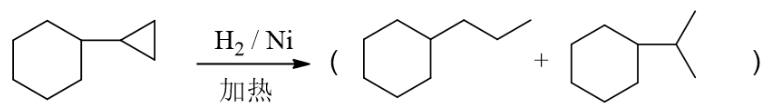
类似在线习题中的最后一道反应题,催化情况开三元环,无区域选择性,得到两个主要产品。
- 第五章习题4(3):反应
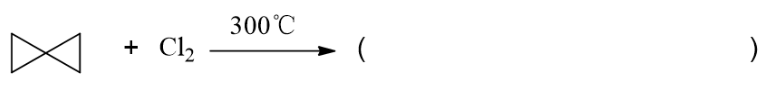
两个三元小环相连的螺环烷烃,与氯气反应。很多同学第一感觉是开三元环。但注意这里300度的高温。 这样高的温度下,还没等氯分子和三元环发生加成,自身就已经被解离成了氯自由基,进而引发自由基卤代。
因此本题相当于开环加成与自由基卤代的竞争,高温下偏向于后者。这里我们做题时也是约定发生单取代, 再加上环上能发生取代的位置极其对称,最终我们将生成单一的产品:
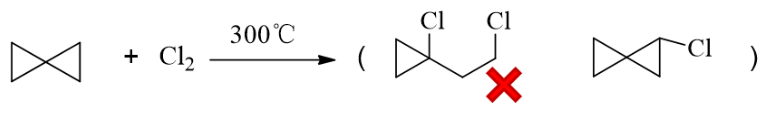
- 第五章习题4(4):反应

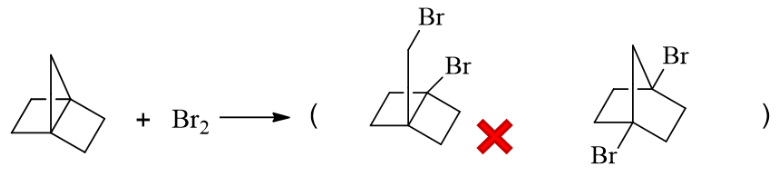
与前一题相比,本题是在常温下进行反应了,没有生成自由基的条件,只能是小环开环。底物分子中 有三元、四元两种小环,考虑到三元环的张力更大更不稳定,这儿应当是三元环优先与溴反应。
此外,我们还需注意三元环反应时究竟断那根键,在哪个方向开环。如果断开旁侧桥头碳与仲碳间的 共价键,我们将得到下图中左侧产品,产品中依然有小环四元环,稳定性不佳。反之如果断开下方 两个桥头碳原子之间的键,则得到下图中右侧产物,只剩下了五元环,稳定性明显高得多。因此本题 的主要产物将是右侧那个。
注解
上面几道课本中的反应题,在重点小结:小环烷烃的反应中也有更详细的讨论。
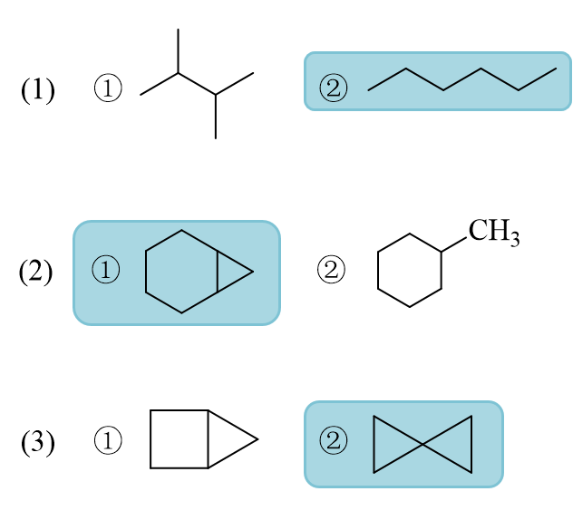
- 第五章习题6:问答
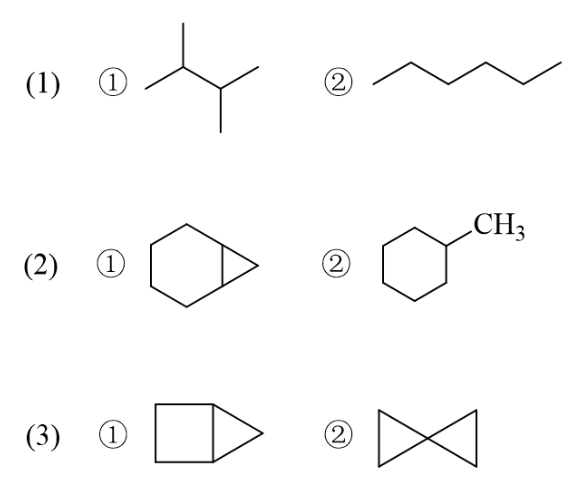
下列各组化合物中哪一个的燃烧热更高?
所谓燃烧热,无非指的是分子充分燃烧过程中放出的能量。对于只含有碳氢的烃类化合物,燃烧后都是生成二氧化碳与水。 而分子式相同的烃,燃烧后得到产品的量还都一模一样,或者换句话说,反应终点的能量状态相同。既然终点能量没区别, 我们也很容易想象,起点——也就是燃烧前的烃——如果越不稳定,热力学能量越高,反应过程中跌落的能量差值会越大,燃烧热 自然也就会越高。
因此这道题其实说白了,就是在比较分子的热力学稳定性。
对于(1),两个分子式相同的开链烷烃,一般来说支链越多热力学能量越低——这与所谓的“超共轭效应”有关。 这个效应不在基础有机的考试范围之内,大家也只需要记得结论就成。
(2),明显左侧带小环的更不稳定。
(3),右侧两个三元环稳定性不及左侧三元+四元。
因此,本题答案如下:
- 第五章习题7:结构推断
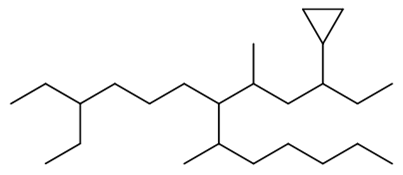
化合物A (C6H12),在室温下不能使高锰酸钾水溶液褪色,与氢碘酸反应得B (C6H13I)。 A氢化后只生成3-甲基戊烷,推测A和B的结构。
本题难度不大,但需要注意题中的一句话: A氢化后只生成3-甲基戊烷。而我们知道小环烷烃的催化情况不具有区域选择性,各根键都可能断开。现在A只生成一种 产物,意味着分子A的结构非常对称,随便断开哪根键,生成的都是3-甲基戊烷。依据这样的思路,不难得到A与B分别为: