习题讲解:烯烃
在线自动评分习题
总分 |
29 |
平均分 |
20.4(70.3%) |
最高分 |
29(100.0%) |
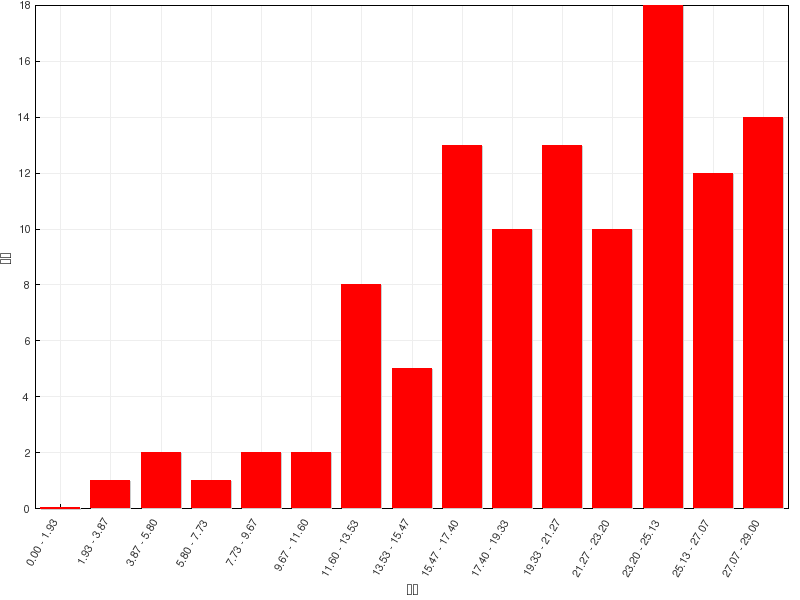
成绩分布
- 题2:命名(错误率44.8%)
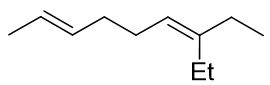
还是那句老话:命名的时候一定注意构型。本题构造很简单,但注意左侧双键存在顺反异构,而且构型在键线式中 体现地非常明显,反式或(E)构型。至于右侧双键,右边碳原子上实际连接了两个相同的乙基,无顺反问题。
最终整个分子应命名为:(E)-7-乙基-2,6-壬二烯。
- 题3:命名(错误率33.3%)
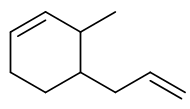
当然并不是说所有情况下双键的构型都一定要标记,比如当前这题。母体明显是环己烯,环上双键看起来应当是个顺式或(Z)构型, 但这个构型在命名时并不用写上。原因也很简单:它在一个不太大的环上。如果双键是反式或(E)构型,大家可以自己画一下, 整个六元环在空间上就没法儿闭合了。因此类似这样的,非特大环上的烯烃双键,构型一般不用特别标注。整个分子可 称为:3-甲基-4-烯丙基环己烯。
- 题4:命名(错误率59.5%)
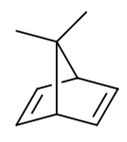
本题稍有难度,出现了我们在课本里没见过的桥环烯烃,有些同学一时摸不着头脑。但其实也不困难,桥环烯烃没见过,可桥环烷烃 我们已经很熟悉了。比如把题干里的双键都换成单键,如下的桥环烷烃:
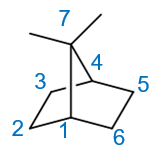
编号如上图所示,应称为7,7-二甲基二环[2.2.1]庚烷。
现在无非就相当于把刚才的桥环烷烃加了两根双键,变成了二烯。对于桥环烯烃而言,编号原则基本与桥环烷烃一致,这里母体编号与之前的烷烃相同,如下图所示。
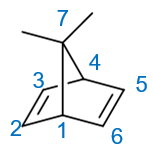
最终的名称,也就是在烷烃的基础上做一些变化,把庚烷换作2,5-庚二烯,称为7,7-二甲基二环[2.2.1]-2,5-庚二烯。
- 题7:名词解释:烯丙基碳正离子(错误率41.4%)
这题其实很简单,结构大家都知道,无非如下图所示:
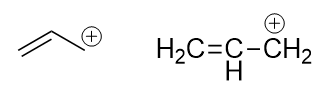
烯丙基碳正离子的键线式与缩写式
但绘制在纸面上的时候有些同学会犯个小错误,写成如下的形式:
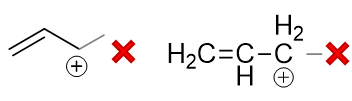
两相比较,明显多了一个小横键。这其实是把烯丙基与烯丙基碳正离子弄混了,这两个名词的含义完全不同。 前者是一个电中性的取代基,如果单抽出来,我们书写结构的时候确实需要这根小横键:
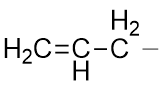
右端这条小横线实际是标识烯丙基与母体相连的位置。从某种意义上说,我们可以把右端这根横线理解成是和母体相连的那根键的一半, 也就是半根共价键,相当于一个电子(但是千万别画成单电子如CH2=CH-CH2·,这又成了烯丙基自由基了)。
当前题目要求我们书写的是烯丙基碳正离子,是个独立的离子,不与任何母体相连,自然不存在这根连接键。此外正电中心碳上p轨道是空的, 没有电子,这个短横更是不应当存在。
离子、自由基、取代基,这三个概念不同,纸面上的画法也各不相同,请大家注意体会其中的区别。
- 题10:反应(错误率43.2%)
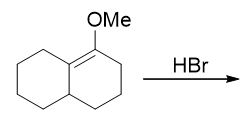
本题具有相当的迷惑性。很多同学给出了如下看起来似乎遵循马氏规则的答案,但很遗憾并不正确:
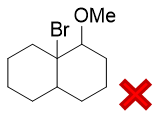
为何如此,我们还是要通过反应机理来分析。加成第一步,还是先上质子形成碳正离子,无非有两种可能性:
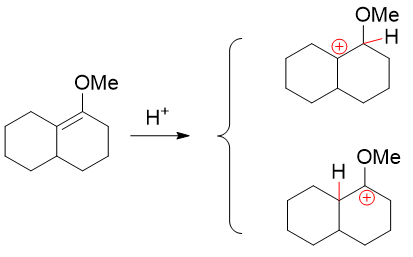
一种形成普通的叔碳正离子,另一种仲碳正离子连接烷氧基。两相比较,这俩碳正离子结构上的差别无非就是一边连接烷基一边连接烷氧基。 烷基我们很熟悉了,+I,给电子共轭效应可以帮助正电荷分散。关键是烷氧基。
有的同学第一感觉认为烷氧基这里是吸电子的,毕竟氧的电负性比较大,具有-I效应。但仔细观察底下的这个碳正离子中间体,正电中心碳 sp2杂化,与氧直接相连,而氧原子的p轨道又存在孤对电子,于是C+与O之间,实际可以发生p轨道的侧面 交叠,形成类似共轭的情况,如下图所示:
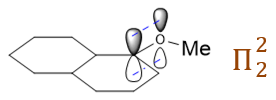
而且交叠后,C+的p轨道是空的,不出电子,O出一根p轨道上的两个电子,会形成两中心两电子的体系,粗略里看,大致相当于 C、O两个原子差不多能各分到一个电子。共轭前C上p轨道是零个电子,共轭后差不多分到一个,电子云密度实际大大上升了。换句话说这里O实际相当于 通过共轭,向碳正中心推电子,具有明显的+C效应。
一面是-I,一面是+C,而一般情况下(注意也并不是所有情况下)杂原子的共轭效应总是明显强于诱导效应,两相叠加的效果, 甲氧基在这里相当于是个挺强的给电子基团,给电子能力远强于烷基。与氧直接相连的这个碳正离子,稳定性也是远强于另一种叔碳正离子。
注解
关于诱导、共振效应的更多讨论,请详见 诱导效应与共轭效应、碳正离子的稳定性。
此外,在下一章中我们会接触共振论,如果以共振论的观点,正电碳与氧直接相连的这种中间体,我们还可以画出它的一对共振极限式来,如下图 左边所示。其中右侧氧上带正电荷的极限式,C、O均满足八隅体规则,稳定性还是不错的。中间体的实际结构相当于这俩共振极限式的平均化, 大致如下图右侧所示,C、O两个原子都带有部分正电荷,相当于电荷被分散开来了,这无疑也有助于离子稳定性的提高。
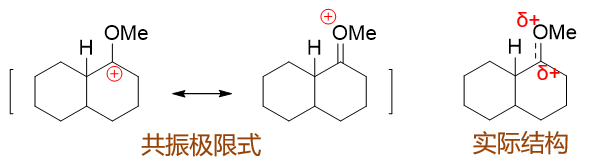
注解
关于共振论的讨论,请详见下一章的 重难点小结:共振论(1)、 重难点小结:共振论(2)。
综上所述,既然我们判断出与氧直接相连的这个碳正离子更稳定,反应也就倾向于朝这个方向走,接下来Br-与C+结合, 最终主要生成下图中右下角的产品。
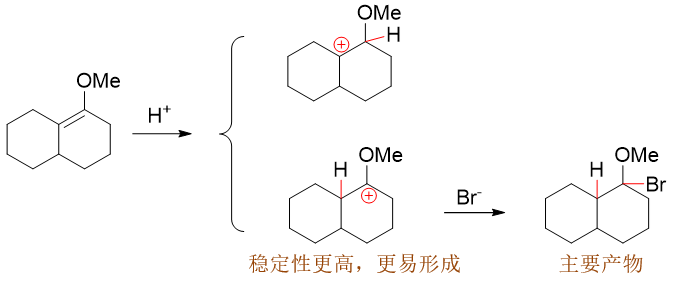
这个反应看起来H加成到了连接支链比较多的碳原子上,表面看起来似乎违背了马氏规则,但实质上正是碳正离子稳定性的体现。 大家在判断亲电加成区域选择性的时候,也千万别死记马氏规则里的什么氢数支链数什么的。更多的情况下,通过机理,通过中间产品的稳定性去判断 得到的结论更加稳妥些。
- 题11:反应(错误率32.4%)
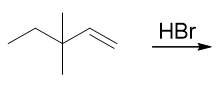
本题看着挺容易,似乎就是个普通的亲电加成,得到遵循马氏规则的产物:
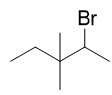
但实际情况没这么简单。注意到质子首先与双键加成后,生成的是一个仲碳正离子,而与此同时旁侧有个季碳,因此很容易发生碳正离子重排, 生成更为稳定的叔碳正离子:
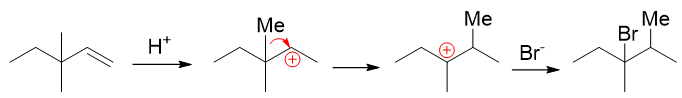
这种能够增强碳正离子中间体稳定性的重排,相对来说比较容易发生。因此,该反应的主要产品,也是上图中重排之后再与溴负离子结合的产物。
- 题13:反应(错误率32.4%)
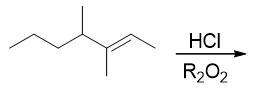
本题也不难,但存在一个小小的陷阱。
我们注意到反应条件里有个R2O2,很多同学一看这个,立马联想到过氧化物效应,于是给出了反马氏规则的结果:
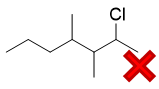
很遗憾又错了。别忘了,只有HBr与烯烃加成的时候才存在过氧化物效应,才能转变为自由基加成的机理。 如果我们把题干中的HCl换成HBr,没错儿,确实主要会得到反马氏产品:
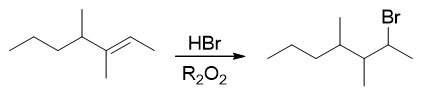
然而现在是HCl,氯自由基在当前条件下不易形成,因此本题的反应依然还是普通的亲电加成,生成碳正离子的过程。换句话说,这里有没有过氧化物, 得到的产品都一样:
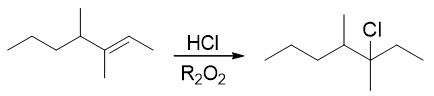
- 题17:反应(错误率45.1%)
17-20小题的反应,都涉及立体选择性,题干中也有特别的标注。当然,底物烯烃分子双键附近不对称,往往也同时涉及区域选择性问题。
本题水溶液中加溴,注意这里水溶液的条件,水本身具有亲核性,可以对正离子进攻,这导致最终的加成产物不是双键碳各加一个溴,而是一边上溴一边上羟基, 加成时区域选择性上也遵循马氏规则。此外,这里由于是溴的加成,我们也很熟悉,反应中会形成溴鎓离子,导致下一步水只能从溴的背面进攻,最终得到的 羟基与溴总是处于环平面异侧,立体选择性上是个反式加成。反应过程大致如下图所示:
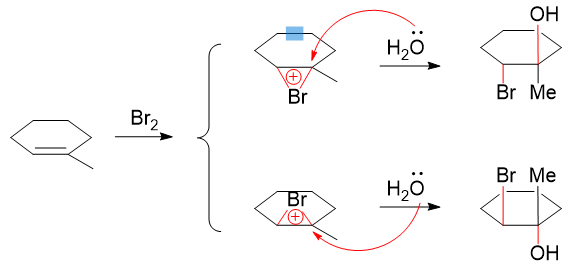
注意这里第一步生成的溴鎓离子存在两种可能:溴位于六元环上或环下,这导致最终我们也会得到一对主要产品,刚好互为对映异构体。 最终产物的立体构型,使用上图中的环平面式或者类似下面的楔线式画出,都没问题:
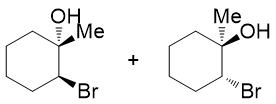
- 题20:反应(错误率35.6%)
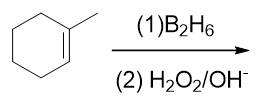
底物分子与上题相同,条件上明显是硼氢化-氧化。而硼氢化-氧化我们知道立体或者区域选择性都非常鲜明,区域选择性反马氏, 立体选择性由于经历四元环状过渡态,总是顺式加成。
反马氏的区域选择性,意味着我们最终会得到如下构造的产物(这里先不考虑构型):
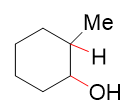
而立体选择性的顺式加成,请特别留意,指的是加成过程中新形成的两根键,也就是上图中的C-H与C-OH键,反应结束后是顺式关系,处于环平面同侧, 并非是说反应结束后取代环烷烃的构型是顺式(请体会这个区别)。像上图的产品,-H、-OH总是处于六元环一侧,而与-H相连的碳原子上原先还有个甲基, 总是会被挤到环的另一面去。由于新形成的C-H、C-OH键可能处于环上方,也可能处于下方,最终我们还是形成一对对映异构体:
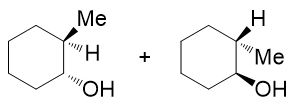
- 题18:反应(错误率46.4%)
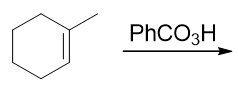
这题其实比较简单。看条件,过氧酸氧化,我们知道会把烯烃双键氧化成环氧三元环,相当于单个氧原子与两个双键碳同时成键。这单个氧原子自然可能从 六元环上方,或者从下方两个方向与双键靠近,于是我们也会生成一对对映异构体:
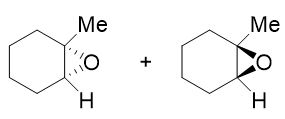
上面的结构表达中,我们使用楔线式标识氧原子处于六元环上方或下方。这两组楔线画在三元环上,略微显得有些不好看。因此习惯上我们更多场合会换一种 构型的标识方法。注意到生成的产品实际是个桥环化合物,与O相连的两个原子都是桥头碳,它们各自又连接了Me与H。当前桥头碳与O相连的两根C-O键,无疑总是 处于六元环一侧,而剩下的Me与H,一定是处于六元环的另外一侧。因此我们用楔线去标记C-Me、C-H键,同样可以起到标识桥环构型的效果,如下图所示:
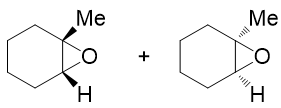
这两组楔线式,实际结构是等同的。
- 题19:反应(错误率31.5%)
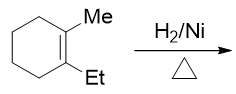
本题在这一系列涉及立体化学的反应题里应该说是最简单的一道。催化氢化,无所谓区域选择性,立体选择性又是个顺式加成,新形成的两根C-H键将处于六元环的 同侧,而原本双键碳上连接的甲基、乙基被挤到另一侧,又是生成一对对映异构体:
注解
关于烯烃不同种类加成反应区域、立体选择性的讨论,请详见 重难点小结:烯烃的四类加成反应。
在线手动评分习题
本章中还另有三道手动评分练习题。
名词解释,不用多说。这里完成名词解释题时(包括考试时),大家无需像做政治考卷那样写大段的文字,直接用反应式或结构式表达出题干中的概念即可。 如本题马氏规则,大家只要随便举一个遵循马氏规则的亲电加成反应实例即可。
机理题,实际就是个碳正离子的扩环重排,可参见重难点小结:碳正离子重排中 五元环重排成六元环的例子。
最后合成题值得稍稍讨论一下。
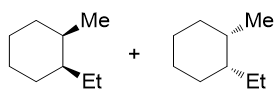
- 合成:请以环己烯为主要有机原料合成1,2,3-三溴环己烷。
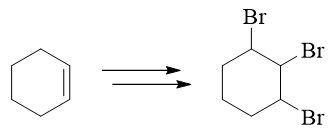
比较起始原料与生成物,我们发现原料中的双键消失了,而多了三个溴原子。双键与溴明显是存在关联的,大家很容易想到烯烃与溴分子的加成:
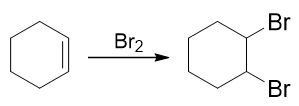
但这还欠着一个溴。怎么样加上这第三个溴去,很多同学接茬儿想到了烷烃的自由基卤代:
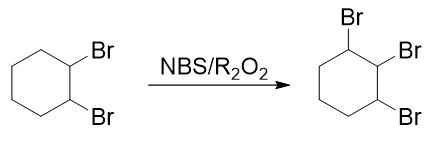
看着挺好,但这步其实存在很大的问题。
这步自由基取代中,我们的愿望是让溴取代3-位仲碳上的氢原子。但注意到这步的反应物,1,2-二溴环己烷中远不止一个仲碳,3-到6-位,发生自由基取代 的活性其实都差不多。因此这里我们没法儿保证发生取代的位置,最后会形成1,2,3-、1,2,4-三溴环己烷(甚至1,1,2-三溴环己烷)的混合物,产率不但受影响 后期分离也困难。
注解
非但有区域选择性不强的缺点,烷烃的自由基卤代还特别容易发生多取代,导致副产品增多。因此在合成里,请大家尽可能不要使用烷烃的卤代反应。
既然这条路线行不通,这个合成又该怎么完成呢?说起来其实挺简单:把加成与自由基卤代反应颠倒一下次序:
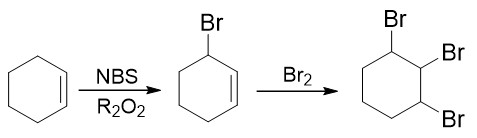
第一步,先做自由基卤代。注意这里的反应物不是烷烃,而是烯烃。我们知道烯烃的自由基卤代选择性较烷烃强多了,基本总是在双键的α位发生,通过 控制反应物用量,我们也比较容易保证主要得到单取代产品。接下来的加成反应,更是没有什么其它选择。最终我们将大量得到题目中要求的目标分子。
注解
NBS/过氧化物是合成中常见的产生溴自由基,引发自由基取代的反应条件。而做自由基氯代时,我们经常会使用Cl2/hv。这两个 条件大家千万别混到一起去,写出NBS/hv或者Cl2/R2O2这样的组合。
课本习题
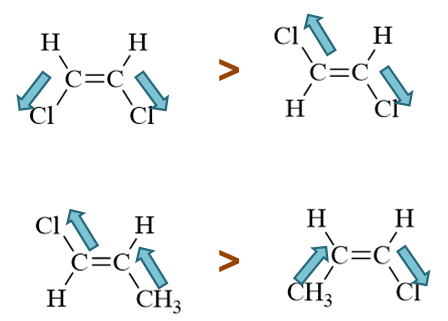
- 习题4:下列两对化合物哪一个的偶极矩更大?
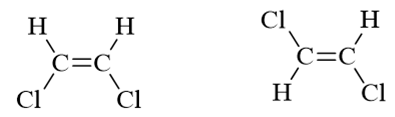
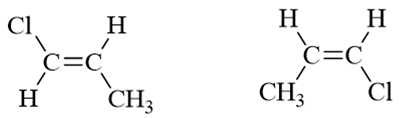
分子的偶极矩,某种角度上说,相当于各根共价键极性的矢量和。而共价键的极性,又与成键原子的电负性有关。电负性又可以令我们联想到诱导效应。 题目中两对分子,C-H键我们在讨论诱导效应时提到过,可以看成是考察诱导效应时的标准状态。至于氯与甲基,分别有吸电子与给电子诱导效应。将诱导效应 的方向在分子中标记出来,再作矢量加和,我们不难得到偶极矩的次序:
- 习题8(2):机理
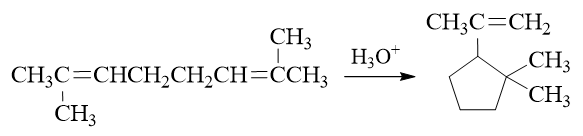
本题具有一定难度,也略微有些超纲,但反应历程我们依然是能够理解的。
首先注意到反应条件是质子性环境,存在大量H+,而缺电子的质子明显可以对双键发动亲电进攻,类似我们正常亲电加成的第一步,生成碳正离子。 底物分子中两根双键对称,随便进攻哪根都一样,这里我们假设质子进攻1-、2-位碳间双键(注意此处编号并非命名编号,仅为说明方便起见):
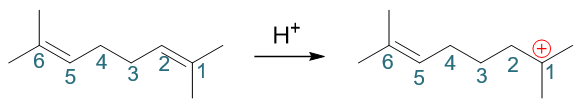
接下来一步会略微有点儿出乎意料,但也可以想象。形成碳正离子后,我们右端1-位碳原子明显是带正电荷缺电子的,而与此同时,分子内部还有一根双键, 电子云密度又比较高。很自然,这时双键与碳正会互相吸引,逐渐靠近乃至于成键,我们把分子弯折成下图,大家看得会比较清楚:
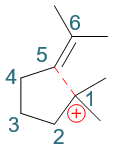
当然,这里其实存在两种可能,5-、6-位双键碳实际都可能与正电子中心成键。但一方面,题干中我们已经知道最终产品是个五元环,另一方面,大家如果有兴趣 可以自己画一下,6-位于碳正中心成键的话形成新的碳正离子稳定性不及5-位,因此这儿我们可以断定,靠近后5-位碳原子与1-位碳正中心键将形成新键。
形成新键需要一对电子,1-位碳正中心肯定没电子,这俩电子都来自于5-位。但当前5-位碳也没有未成键电子对,必须拆东墙补西墙,断开旧键解放出电子来。 明显,5-位旁侧最容易断开的是键能较低的π键,相当于把原本π键断开,两个电子都用来与1-位形成新的σ键。大致下图所示:
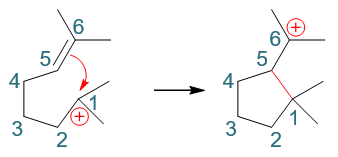
而这一对来自于π键的电子原本是5-、6-位碳各出一个形成的,现在两个都被5-位拿去成键,相当于6-位失去了一个电子,将带有正电荷。换而言之,正电荷相当于 从1-位转移到了6-位,我们得到一个新的叔碳正离子。
正常亲电加成,这步得到碳正离子后接下来该是卤负离子的进攻了。但当前题干里我们发现,生成的不是卤代烃(条件里也没有卤负离子),而是得到一个新的烯烃。 对照当前碳正离子的结构,相当于还得形成一根新的双键。这根双键该又如何形成?
其实也挺简单,我们很熟悉质子加成上双键,形成碳正离子,但别忘了,所有的反应过程原则上都是可逆的,质子加成这步也不例外。如果反方向走,断开C-H键, 一对电子转移到C-C之间形成π键,碳正离子又可以转变成烯烃的结构:
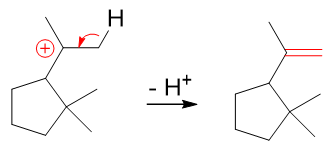
这个过程我们后面学习到卤代烃一章,大家会发现,实际就是所谓的E1消除。而消除后的产品,恰恰就是题干中的生成物。
到这儿,我们就可以连缀起来,写出整套反应的历程来:
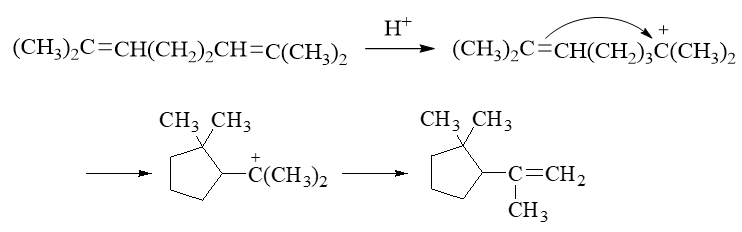
这个历程看似从没接触过,但从电性反应的本质:正负相吸,再结合题干中的最终产物,我们其实也不难推导出大致流程。还是那句老话,有机反应大家千万 别去死记,一定要掌握原理掌握规律。一旦理解了规律性的东西,那怕是之前从未见过的反应我们经常也能推断出结果来。