习题讲解:炔与二烯
在线自动评分习题
总分 |
37 |
平均分 |
27.8(75.1%) |
最高分 |
36.8(99.3%) |
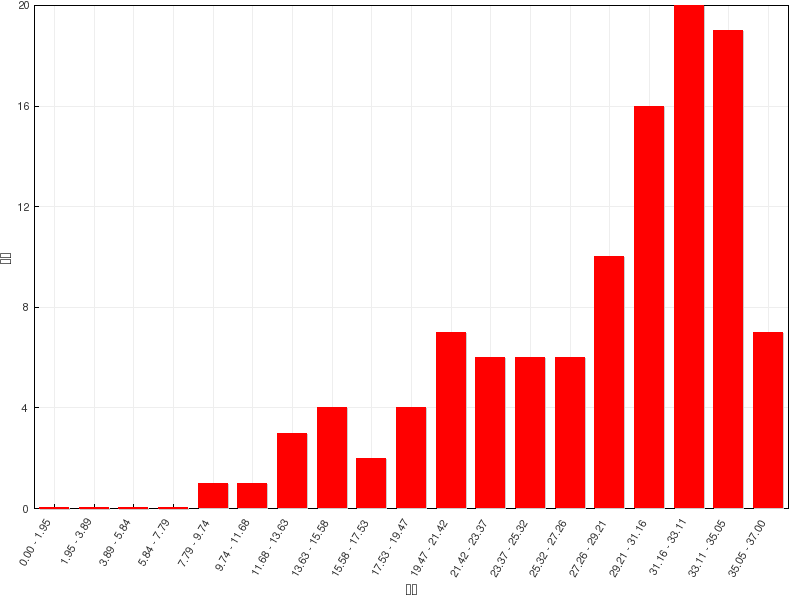
成绩分布
本章习题数量较多,但难度不算很大。错误率比较集中在命名中的构型、反应活性判定、共轭二烯的反应这些知识点上。
- 题5:命名(错误率55.1%)
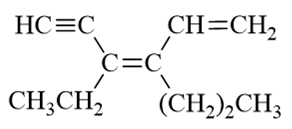
题干中是个开链烯炔,我们需要将官能团双键与叁键尽可能都放在母体当中。显然母体应是上方的六碳链。编号两种可能, 如下图所示。从左向右或从右向左,三个官能团(不考虑双叁键差别)位置均在1-、3-、5-位,这时应尽可能使双键位次较小, 我们从右向左取红色的编号方式。整个分子构造名称应为4-乙基-3-正丙基-1,3-己二烯-5-炔。
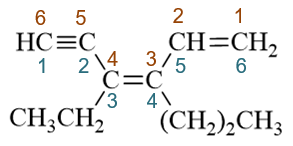
应取红色编号方式
但光写出这个名称还是不够的,注意到3-位双键存在顺反异构,当前明显是Z构型,这一因素需要在命名中体现出来。因此整个 分子最终应命名为(Z)-4-乙基-3-正丙基-1,3-己二烯-5-炔。
- 题7:命名(错误率44.2%)
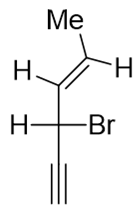
还是开链烯炔,本身构造并不复杂,我们依然把双、叁键都放在母体里,取竖直碳链为母体。为保证双键、叁键位次尽可能小, 应采取下图中红色自下而上的编号方式。构造名称为3-溴-4-己烯-1-炔。
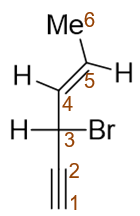
同样,本题分子中依然存在构型问题,而且构型要素还不止一个。首先是4-位双键存在顺反异构,当前应为E构型。其次注意3-位 碳原子,连接了四个不同基团,是手性中心。当前的画法该碳原子周边单键形成了一个十字交叉,明显是Fischer投影式, 可判定出此手性中心构型为S。
这两个构型要素我们需在命名时列在构造名称之前,但一般别写成(S,E)或者(E,S)这样。对于含多个构型要素的分子,单纯列出 构型标识来得话指代位次显得有些不明确,应在E/S之前写上构型中心的位次,且依据位次由小至大的次序列出,整个分子应称为 (3S,4E)-3-溴-4-己烯-1-炔。
注解
如果分子中仅含单个构型要素(单个手性中心,或单根顺反双键),则此时不会引起混淆,构型标识前无需额外加注数字。
- 题6:命名(错误率40.2%)
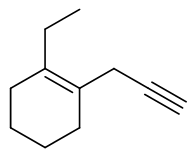
本题亦为烯炔,但分子中含环,因此无论如何也无法将双、叁键均置于母体之中。这里环外链不复杂,我们一般总是以环作为母体。 当前母体实际就是个简单的环己烯,双键视作主官能团。主官能团上两个双键碳分别编在1-、2-位,如下图所示,又存在红、蓝 两种不同的编号方式。这两种编号方式官能团双键都在1-位,没区别,但两个环外取代基位次不同。这时我们需要尽量照顾优先级 较小的取代基,使得乙基位次较小,即取红色的编号方式。最终分子应命名为:1-乙基-2-炔丙基-1-环己烯。
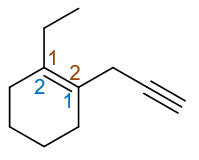
应取红色编号方式
当然,如果母体是环烯烃,那主官能团双键编号总是在1-位,因此这里的双键编号我们经常可以省略,称为1-乙基-2-炔丙基环己烯。
- 题15:排序(错误率39.3%)
请将下列化合物按与HBr发生反应的活性降序排列:
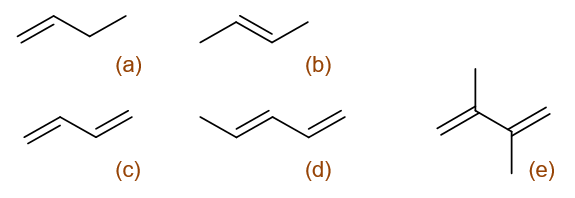
本题考查一系列单烯烃或共轭二烯烃的亲电加成活性。无论是何种烯烃,与HBr发生加成的速控步都是生成碳正离子,而得到碳正离子 越稳定,通常速控步活化能越低越容易发生,反应速率也就越高。
依据此原则,我们可以先写出这一系列分子各自生成的碳正离子(当然遵循马氏规则):
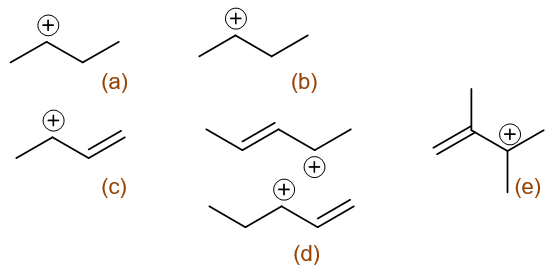
这一系列碳正离子首先可以分为两大组:(a)与(b)生成的碳正离子相同,均为烷基碳正离子。(c)-(d)则生成主要生成旁侧有一根 双键可参与共轭的烯丙基型碳正离子(注意d这里看起来存在生成两种结构不同的主要碳正离子的可能性)。明显,有共轭的(c)-(d)稳定 性要强得多,换句话说原本一系列分子中的共轭二烯烃反应速率总会高过单烯烃。
而在三个二烯烃生成的碳正离子中,(e)得到的碳正离子旁侧较(c)、(d)生成的还额外多了一个给电子的烷基,因此它的稳定性最高。二烯烃 中也就是(e)的反应速率最快。
但问题是看起来(c)、(d)的碳正离子看起来结构类似:都是有一根双键共轭,都是仲碳正离子,稳定性应当相仿,这下反应速率该如何比较呢?
仔细看(c)、(d)形成的碳正离子结构上还是存在一点儿区别的,(d)相当于在(c)的基础上还额外多了个甲基。这个甲基虽说距离碳正中心比较 远,但多多少少总会有点儿影响,总能推一点儿电子过来。因此,(d)形成碳正离子的稳定性将略高于(c)。
此外,亲电取代的反应速率除了与生成的碳正离子稳定性相关外,还有另外一个显著的影响因素:双键上电子云密度。毕竟进攻试剂是缺电子的, 双键上电子云密度越高对进攻试剂吸引力越大。而(c)、(d)两种共轭二烯两相比较,(d)在双键上还多了一个具有+I效应的甲基,因而双键上 电子云密度将高过(c)。从这个角度而言,反应活性上(d)也将较(c)略高。
同理,同为单烯烃的(a)、(b),(b)双键同时连接了两个个电子甲基,(a)只连接了一个乙基,因而(b)双键的电子云密度更高,反应活性也更强。
综上所述,这一系列烯烃分子亲电加成反应活性次序应为:(e)>(d)>(c)>(b)>(a)。
- 题16:排序(错误率42.0%)
请将下列化合物按Diels-Alder反应活性的降序排列:
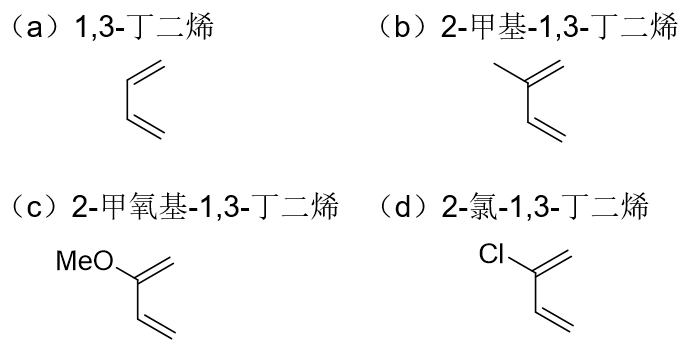
这一系列分子均为共轭二烯,均可与亲双烯体发生Diels-Alder反应。而共轭二烯参与D-A反应时,我们知道共轭双键体系电子云密度越高 对反应越有利(反过来亲双烯体双键上电子云密度越低越有利),因此本题说白了相当于是考查共轭双键上连接基团的电性效应。各基团的 电性效应情况大致如下图所示:
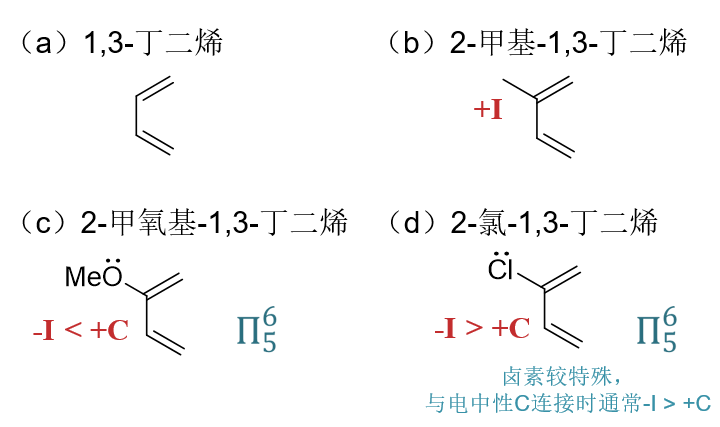
分子(a)为1,3-丁二烯,(b)~(d)相当于是在1,3-丁二烯的2-位额外连接了甲基、甲氧基和氯原子。这三个基团的电性效应在我们之前的 学习过程中实际都接触过。
(b)中的甲基,很单纯的诱导给电子效应。与双键之间不存在共轭,无共轭效应。总体上是个弱给电子基团。
(c)中的甲氧基,氧电负性较强,-I,但同时氧原子p轨道上一对电子可以参与共轭,与四个双键碳形成五中心六电子共轭体系,粗略里看 每个碳原子差不多可以分到6/5个π电子,较1,3-丁二烯每碳一个π电子明显来得高,相当于通过共轭甲氧基向双键碳一侧提供了电子,具有 明显的+C效应。对于杂原子而言,一般总是共轭效应要强于诱导效应,这里两相叠加,甲氧基是个相对较强的个电子基团,共轭双键上电子云 密度也较2-甲基-1,3-丁二烯更高。
(d)旁侧连接的是Cl,情况与甲氧基相仿,诱导吸电子,共轭给电子。但卤素原子比较特殊,当其与电中性碳相连时,往往-I比+C效应更强, 整体上是个弱吸电子基团(常见杂原子中唯独卤素具有这个特殊的特性)。因此(d)的反应速率将较1,3-丁二烯为低。
综上,这四个二烯分子Diels-Alder反应活性次序应为(c)>(b)>(a)>(d)。
注解
关于含杂原子基团共轭/诱导效应的更详细讨论,可参见芳烃一章的 重难点小结:苯环上已有基团对后继亲电取代的影响。
- 题17:反应(错误率29.4%)

本题其实特简单,无非是叁键还原为双键。留意到Lindlar催化剂催化氢化一定是生成顺式烯烃,反应具有鲜明的立体选择性。 虽然题干里因为疏忽没有提醒,但绘制键线式时,顺式双键其实很容易表达出来:

- 题22:反应(错误率29.5%)
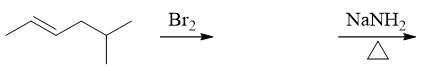
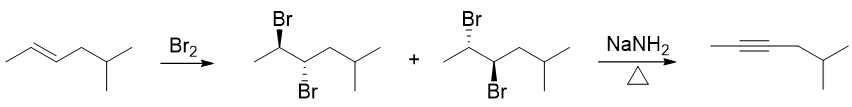
两步串联反应。第一步无疑是烯烃与溴的亲电加成,需要注意的是溴的加成存在明显的立体选择性(题干中也特别强调了这一点),反式加成将得到一对对映异构体, 我们可以利用楔线式表达出它们的构型,如下图所示。而后无论哪种异构体,第二步强碱性条件下都会消除得到相同的炔烃。
- 题24:反应(错误率78.2%)
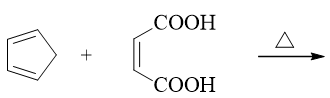
明显是Diels-Alder反应。这儿由于共轭二烯分子里有个五元环,很多同学就画不准最后的产物了。其实特简单,D-A反应只是发生在共轭二烯两根双键四碳区域与 亲双烯体双键两碳区域之间,分子里的其它部分都不涉及,也不发生变化。找出这两个反应区域,端头连键(下图中蓝色虚线)关出六元环,如是而已。原本五元环, 反应过程中又新生成了六元环,最终我们将得到一个桥环分子。
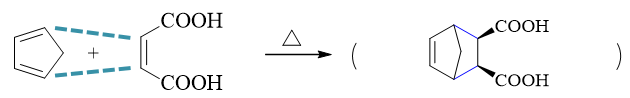
此外,注意到原亲双烯体双键是个顺式构型,我们也知道D-A反应立体选择性上是顺反保持的,反应结束后,两个羧基依然也是顺式。生成的分子里存在对称面,不具有手性, 顺式结构也只有这一种。
题25:反应(错误率34.4%)
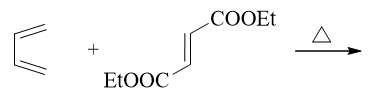
与前一题类似,也是考察D-A反应的立体选择性。这里反应结束后,两个酯基将在六元环上处于反式。此外,反式构型的生成物里不存在对称面与对称中心, 是个手性分子,反应中将生成一对对映异构体。
在线手动评分习题
本章中还有两组手动评分习题。其中名词解释不用多说,三道合成题都可以使用我们之前介绍的逆合成分析的手段倒推思路。
注解
关于逆合成分析的讨论,请参见本章 重难点小结:合成题与逆合成分析。
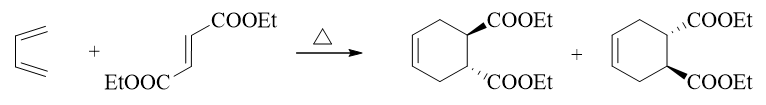
- 合成:请以丙烯为主要有机原料合成(E)-1,4-己二烯。
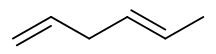
目标分子如上图所示,明显注意到目标分子中存在一根立体构型确定的双键。以我们当前已有的知识,合成这种确定的反式双键几乎只有 一个手段:利用炔在Na液氨体系下的低温还原。因此依据逆合成分析,目标产品应当来自于下图中右侧的烯炔:
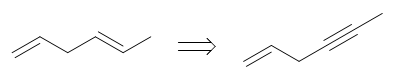
该烯炔总共六碳,而原料丙烯三碳,这也暗示我们,合成过程中势必涉及C-C键的生成,从小分子合成大分子。相应地逆合成分析时我们 需要断开大分子中C-C键将其剖开为小分子。断键位置实际非常确定,肯定是叁键左侧,如下图所示。将六碳分子分为3+3两个小片段。 叁键旁侧的切断,反过来合成时我们刚好就可以利用炔钠与卤代烃的亲核取代反应。
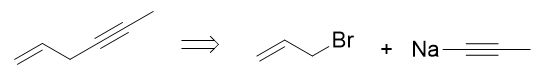
这步我们得到的两个三碳分子,还得往原料丙烯那儿转化。3-溴丙烯很简单,从丙烯出发很容易通过自由基α-卤代生成。至于丙炔,经典 的合成方式是来自于1,2-二溴丙烷这种邻二卤代烃的消除。而1,2-二溴丙烷,刚好又可以由丙烯与溴的亲电加成得到:
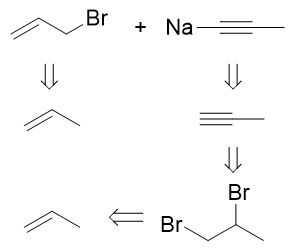
至此,我们的逆合成分析结束,合成思路完成。剩下的任务无非返回头,顺次写出反应:
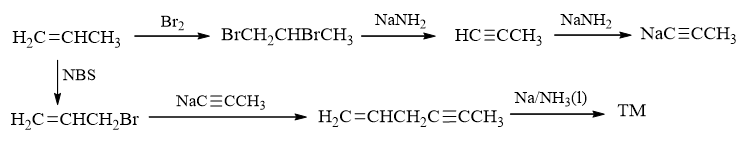
本题是很典型的涉及炔的合成。确定构型的顺式或反式双键,合成里往往来自与叁键,而一旦碳链中有叁键,就可以考虑炔钠与卤代烃 的反应。这是我们合成里两个常用的技巧。
- 合成:请以乙炔为主要有机原料合成丁烯酮。
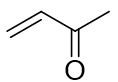
目标分子如上图所示。本题的暗示也非常明显:目标分子中含有一个特别显眼的羰基。到目前为止,我们学习到的能够生成羰基的反应也 就那么几个:烯烃臭氧氧化或是炔烃的水合/硼氢化氧化。合成里一般不会使用烯烃臭氧氧化的手段:毕竟这个反应会断开C=C双键,导致 大分子变成小分子,与一般合成增长碳链的目标相反。因此目标分子中的羰基,应当是来自于叁键:
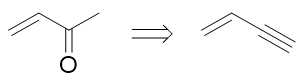
注意到当前是在叁键内侧碳原子上生成羰基,这步合成我们实际需要使用炔烃水合的方法。
当前我们逆推到这么一个四碳烯炔。有些同学又会考虑利用炔钠与卤代烃的反应拼合C-C键:
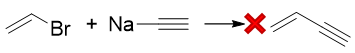
但这其实行不通,毛病主要出在1-溴乙烯身上。我们到后面卤代烃一章就会了解,类似这种卤素直接与双键碳相连的卤代烃,反应活性很低, 是很难与炔钠发生亲核取代的。
事实上我们真要合成1-丁烯-3-炔有个更简单的方案:乙炔的二聚反应,而乙炔刚好就是题目中的原料:
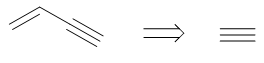
到这儿,我们整个思路完成,最后顺次写出具体反应,一共也就两步:
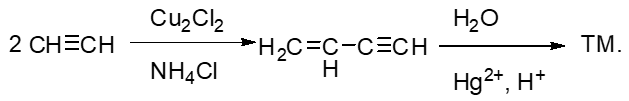
- 合成:请以乙炔为主要有机原料合成如下分子:
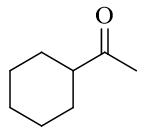
看起来比较复杂,目标分子长得比乙炔大得多。但前两题的铺垫一定程度上可以帮助大家找到本题的思路。
目标分子的结构里实际存在两个能够给我们提供思路的结构特征。首先,一个羰基,类似于上一题,这应当又是来自于叁键。 除此之外,分子中还存在一个六元环。目前为止,我们能够合成六元环的手段只有一个:Diels-Alder反应。在逆合成分析 时,我们就可以先从这儿入手。
比如我们先考虑Diels-Alder反应。D-A反应正向进行是4+2得到六元环,而且环上还有一根双键。目前我们的环上都是单键, 但好在双键很容易通过催化氢化的方式转变成单键,没有任何问题。逆合成分析我们就反其道而行之,先补上双键,再断开环上两根 C-C键,切成四碳、两碳两个部分。比较适宜的切法如下图所示:
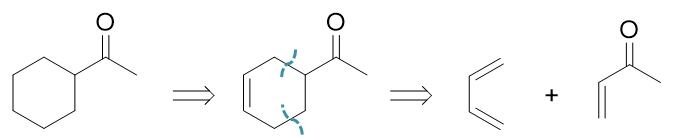
之所以在这两个特定位置切开,主要是这样得到的亲双烯体双键旁侧刚好又个吸电子的乙酰基,对Diels-Alder反应相对比较 有利。
切成这两个四碳分子后,我们先考虑丁烯酮一边。与前一题完全相同,丁烯酮可以来自于1-丁烯-3-炔,又来自于乙炔的聚合。 而1,3-丁二烯,如果与1-丁烯-3-炔对照一下,我们发现,它其实也可以由这个烯炔利用Lindlar催化剂还原得到。如下图 所示,我们的思路就此完成。
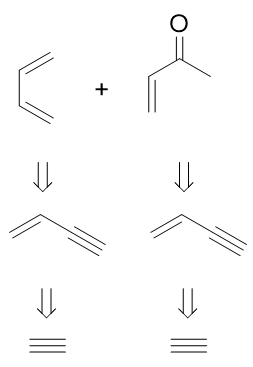
最终顺次写出具体反应如下:
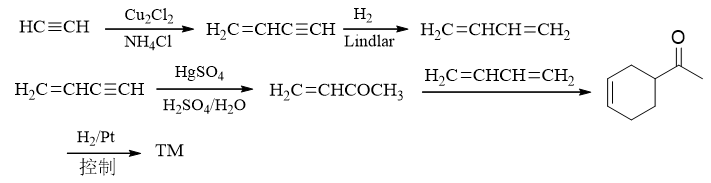
这里还需要小心,最后一步双键还原催化氢化需要控制一下条件,否则羰基也会受到影响,被还原成羟基——这个反应我们将在后面醛酮一章涉及。
课本习题
课本习题中有几道相对有趣的,我们也大致讨论一下。
- 习题4(9):反应
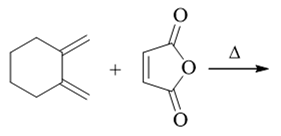
明显是Diels-Alder反应,共轭二烯与亲双烯体内本身都具有环系结构,而这些环在反应过程中不会受到影响,将保持原状外加反应生成 的六元环,最终我们将得到一个含有三个环的新分子:
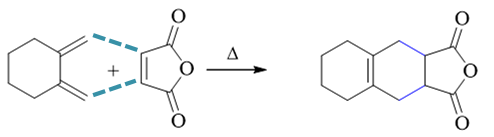
- 习题4(10):反应
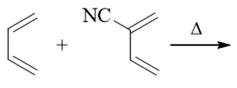
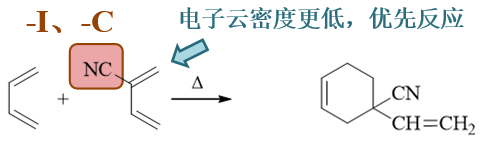
其实还是Diels-Alder反应,反应物两个共轭二烯,其中有一个实际在反应中担负着亲双烯体的角色。究竟谁是亲双烯体我们也不难判断: D-A反应中亲双烯体双键上电子云密度越低越好,而当前明显右侧分子双键上额外连接了腈基(-CN),该基团诱导、共轭效应均为吸电子, 叠加起来吸电子能力挺强,因此右侧分子双键电子云密度必然较1,3-丁二烯为低,更适宜成为反应中的亲双烯体。
当然,右侧分子中还存在两根双键,究竟哪一根与1,3-丁二烯关环呢?其实也容易判断,我们看到吸电子的腈基与上方双键之间距离更近, 对上方双键的影响理应比下方更大。因此,上边双键电子云密度更低些,将优先于1,3-丁二烯发生反应。
得到这些结论后,我们不难写出最终4+2环加成的结果,如下图所示:
- 习题5(1):反应
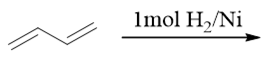
共轭二烯的催化氢化反应。我们知道共轭二烯亲电加成时将存在1,2-、1,4-加成两种主要产物,但这里催化氢化的反应机理与亲电加成 完全不同,压根儿不涉及碳正离子中间体。其反应过程可参见前一章 重难点小结:烯烃的四类加成反应。两个基本游离的氢原子与 双键碳加成成键时,互相之间距离不远,不可能跨越1-位至4-位这么长的距离。因此催化氢化时,共轭二烯与普通烯烃的产物没有太大的 区别,一般不会发生1,4-加成。
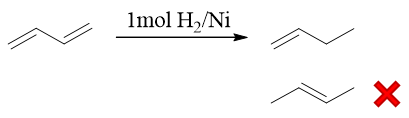
- 习题7:排序
请比较以下碳正离子稳定性: .. image:: ../../images/C05-Exercises/C04_00.png
别的都好办,需要小心的是(4),正电中心旁侧连接了氯原子。我们之前已经了解了,卤素具有-I效应,当其参与共轭时,又会有+C效应, 诱导与共轭效应相反。前面我们看到,卤素与电中性碳原子相连时,-I>+C,整体吸电子。但这里卤素与碳正中心相连,情况将发生变化, 反而会+C>-I,整体给电子。这一点非常特殊,大家一定小心。具体原因可以参见下一章 重难点小结:苯环上已有基团对后继亲电取代的影响里靠末尾关于卤素原子作为芳环旁侧取代基的讨论。
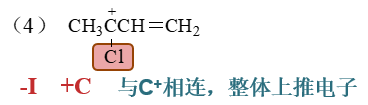
因此,这里(4)的稳定性将最强,次序应为(4)>(3)>(5)>(1)>(2)。